决定强、弱电解质的因素较多,有时一种物质在某种情况下是强电解质,而在另一种情况下,又可以是弱电解质。下面从键型、键能、溶解度、浓度和溶剂等方面来讨论这些因素对电解质电离的影响。
(一)、电解质的键型不同,电离程度就不同
已知典型的离子化合物,如强碱[NaOH、KOH、Ba(OH)2]、大部分盐类(NaCl、CaCl2等)以及强极性化合物(如HCl、H2SO4等),在极性水分子作用下能够全部电离,导电性很强,我们称这种在水溶液中能够完全电离的物质为强电解质。而弱极性键的共价化合物,如CH3COOH、HCN、NH3·H2O等,在水中仅部分电离,导电性较弱,我们称这种在水溶液中只能部分电离的物质为弱电解质。所以,从结构的观点来看,强、弱电解质的区分是由于键型的不同所引起的。但是,仅从键型来区分强、弱电解质是不全面的,即使强极性共价化合物也有属于弱电解质的情况,HF就是一例。因此,物质在溶液中存在离子的多少,还与其他因素有关。
(二)相同类型的共价化合物由于键能不同,电离程度也不同
例如:HF、HCl、HBr、HI就其键能来说是依次减小的,这可从它们的电负性之差或气体分子的偶极矩来说明。
从它们分子内核间距的依次增大,分子的键能依次减小来看,HF的键能最大,分子结合得最牢固,在水溶液中电离最困难。再加上HF分子之间由于形成氢键的缘故而有缔合作用,虽然在水分子的作用下一部分HF离子化,离解为H3O+和F-,但离解出来的F-很快地又和HF结合成为HF2-、H2F3-、H3F4-等离子。在1mol/L HF溶液中,F-仅占1%,HF2-占10%,而大部分都是多分子聚合的离子:H2F3-、H3F4-、……这样就使HF成为一种弱酸,而HCl、HBr、HI都是强酸。从HCl→HI,它们分子内的核间距依次增大,键能依次减小,所以它们的电离度逐渐略有所增大。但是,仅从键能大小来区分强、弱电解质也是片面的,有些键能较大的极性化合物也有属于强电解质的情况。例如,H—Cl的键能(431.4kJ/mol)比H—S的键能(365.8kJ/mol)大,在水溶液中HCl却比H2S容易电离。
(三)电解质的溶解度也直接影响着电解质溶液的导电能力
有些离子化合物,如BaSO4、CaF2等,尽管它们溶于水时全部电离,但它们的溶解度很小,使它们的水溶液的导电能力很弱,但它们在熔融状态时导电能力很强,因此仍属强电解质。
(四)电解质溶液的浓度不同,电离程度也不同
溶液越稀,电离度越大。因此,有人认为如盐酸和硫酸只有在稀溶液中才是强电解质,在浓溶液中,则是弱电解质。由蒸气压的测定知道10mol/L的盐酸中有0.3%是共价分子,因此10mol/L的盐酸中HCl是弱电解质。通常当溶液中以分子状态存在的部分少于千分之一时就可认为是强电解质,当然在这里“强”与“弱”之间是没有严格界限的。
(五)溶剂的性质也直接影响电解质的强弱
例如,对于离子化合物来说,水和其他极性溶剂的作用主要是削弱晶体中离子间的引力,使之解离。根据库仑定律,离子间的引力为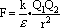 式中k为静电力常量,Q1、Q2为离子的电量,r为离子间距离,ε为溶剂的介电常数。从上式可以看出,离子间引力与溶剂的介电常数成反比。水的介电常数ε=81,所以像LiCl、KCl这些离子化合物,在水晶易于电离,表现出强电解质的性质。而乙醇和苯等介电常数较小(乙醇ε=27,苯ε=2),离子化合物在其中难于电离,表现出弱电解质的性质。
式中k为静电力常量,Q1、Q2为离子的电量,r为离子间距离,ε为溶剂的介电常数。从上式可以看出,离子间引力与溶剂的介电常数成反比。水的介电常数ε=81,所以像LiCl、KCl这些离子化合物,在水晶易于电离,表现出强电解质的性质。而乙醇和苯等介电常数较小(乙醇ε=27,苯ε=2),离子化合物在其中难于电离,表现出弱电解质的性质。
因此弱电解质和强电解质,并不是物质在本质上的一种分类,而是由于电解质在溶剂等不同条件下所造成的区别,彼此之间没有明显的界限。