|
第I卷(选择题,共49分)
一、选择题 (本题包括 5小题,每小题2分,共10分。每小题中有一个选项符合题意。)
1、下列物质中,导电性能最差的是( )
A.石墨棒 B.氧化钠晶体
C.氨水 D.熔化的氢氧化钾
2、下列叙述正确的是( )
A.氯化钠溶液在电流的作用下电离成钠离子和氯离子
B.氯气的水溶液能导电,氯气是电解质
C.溶于水后能电离出氢离子的化合物都是酸
D.硫酸钡难溶于水,但硫酸钡是强电解质
3、在一支25mL的酸式滴定管中盛入0.1mol·L-1 HCl溶液,液面恰好在5mL刻度处,若把滴定管中的溶液全部放入烧杯中,所得溶液体积为( )
A.大于20mL B.小于20mL
C.等于5mL D.等于20mL
4、在pH=9的CH3COONa和NaOH两种溶液中,设由水电离产生的OH-离子浓度分别为a mol·L-1和b mol·L-1,则a与b的关系为( )
A.a>b B.a<b
C.a=b D.无法确定
5、等物质的量浓度的下列四种溶液中,NH4+的浓度最大的是( )
A.NH4Cl B.NH4HCO3
C.NH4HSO4 D.NH4NO3
[答案] 二、选择题 (本题包括 8小题,每小题3分,共24分。每小题有一个或两个选项符合题意)
6、常温下将NaOH溶液和醋酸混合,所得溶液pH=7,则( )
A.c(CH3COO-)>c(Na+) B.c(CH3COO-)<c(Na+)
C.c(CH3COO-)=c(Na+) D.无法确定c(CH3COO-)与c(Na+)的关系
7、在相同温度时100mL 0.01mol/L的醋酸溶液与10mL 0.1mol/L的醋酸溶液相比较,下列数值前者大于后者的是( )
A.中和时所需NaOH的量 B.电离程度
C.H+的物质的量浓度 D.CH3COOH的物质的量
8、当NaOH溶液与氨水pH、体积都相同时,下列叙述正确的是( )
A.两溶液的物质的量浓度相同
B.两溶液中的c(H+)相同
C.用同浓度盐酸中和时,消耗酸的体积相同
D.升高温度10℃,两者pH仍相等
9、在pH=1的含有Mg2+、Fe2+、Al3+三种阳离子的溶液中,可能存在的阴离子是( )
① Cl- ②NO3- ③SO42- ④S2- ⑤CO32-
A.①② B.②③
C.③④⑤ D.①③
10、一种一元强酸HA溶液中加入一种碱MOH,反应后,溶液呈中性,下列判断正确的是( )
A.加入的碱过量
B.混合前酸溶液中的酸与碱溶液中的碱的物质的量相等
C.生成的盐不发生水解反应
D.反应后溶液中c(A-)、c(M+)相等
11、下旬实验事实能说明盐酸是比醋酸强的酸的是( )
A.将pH=4的盐酸和醋酸稀释到pH=5的溶液,醋酸所加的水量多
B.盐酸和醋酸都可用相应的钠盐与浓H2SO4反应制取
C.相同pH的盐酸和醋酸溶液中分别加入相应的钠盐固体,醋酸的pH变化大
D.相同pH的盐酸和醋酸分别跟锌反应,产生H2的起始速率相等
12、从下列现象可以判断某一元酸是强酸的是( )
A.加热该酸至沸腾也不分解 B.该酸可以分解石灰石放出CO2
C.能与Zn反应产生氢气 D.该酸浓度为0.1mol·L-1时的pH=1
13、将0.1mol·L-1 CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会导致( )
A.溶液的pH值增加 B.CH3COOH电离度变大
C.溶液的导电能力减弱 D.溶液中c(OH-)增大
[答案] 三、选择题 (本题包括 5小题,每小题3分,共15分。每小题有一个选项符合题意)
14、下列说法不正确的是( )
A.100℃时,纯水中c(H+)=1×10-6mol·L-1,pH小于7,此时纯水显酸性
B.pH=12的烧碱和氢氧化钡溶液,二者物质的量浓度比值为2:1
C.pH=13的盐酸与pH=5的硫酸等体积混合,pH=3.3
D.0.1mol·L-1 CH3COOH的溶液中,c(CH3COOH)>c(CH3COO-)
15、用某种仪器量取液体体积时,平视时读数为n mL,仰视时读数为xmL,俯视时读数为ymL,若x>n>y,则所用的仪器可能为( )
A.量筒 B.容量瓶
C.滴定管 D.以上均不对
16、为更合理地表示溶液的酸碱性,科学家提出“酸度”(用AG表示)概念,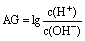 。下列叙述正确的是( ) 。下列叙述正确的是( )
①任何温度下,水的 AG等于0
②溶液的 AG越小,酸性越强
③常温下, 0.1mol·L-1 盐酸的AG=12
④ 25℃时,某溶液的AG=-10,其pH=10
A.①③ B.②④
C.①② D.③④
17、以酚酞试液为指示剂,对某新制的NaOH溶液进行中和滴定实验,数据记录如下表:
|
待测液 |
消耗标准盐酸
(0.1mol · L -1 的体积) |
① |
20mL NaOH 溶液 |
V1 mL |
② |
20mL NaOH 溶液+ 10mL 水 |
V2 mL |
③ |
敞口隔夜放置的 20mL NaOH 溶液 |
V3 mL |
该新制的 NaOH溶液的浓度C合理的是( )
A.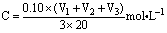 B. B.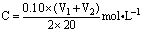
C.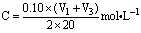 D. D.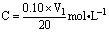
18、某溶液中含Cl-、NH4+、H+和OH-四种离子,下列关于四种离子浓度大小的比较一定不正确的是( )
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.c(Cl-)>c(NH4+)=c(H+)>c(OH-)
C.c(NH4+)>c(Cl-)>c(H+)>c(OH-)
D.c(NH4+)>c(Cl-)>c(OH-)> c(H+)
[答案] 第Ⅱ卷(共 51分)
19、(4分)用pH试纸测定溶液的pH值,正确操作是_____________。
[答案]
20、(9分)有一学生在实验室测某溶液的pH。实验时,他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测。
(1)该学生的操作是_________(填“正确的”或“错误的”),其理由是_____________。
(2)如不正确请说明理由,同时请分析是否一定有误差?
答:______________________________________________
(3)若用此法分别测定c(H+)相等的盐酸和醋酸溶液的pH,误差较大的是__________,原因是_____________________________。
[答案]
21、(6分)在FeCl3溶液中存在下列平衡: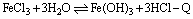
(1)不断加热FeCl3溶液,蒸干其水分,得到的固体可能是________,其理由是_______________________________________。
(2)在配制FeCl3溶液时,防止浑浊,应加入____________________。
(3)在FeCl3溶液中加入一定量Na2CO3溶液,产生的现象是__________,有关反应的离子方程式为__________________________。
[答案]
22、某温度时,水的KW=1×10-13,则该温度(填小于,大于或等于)______25℃,其理由是__________________________。
在此温度下,将 pH=8的Ba(OH)2溶液与pH=5的稀HCl混合,若所得混合溶液的pH=7,则Ba(OH)2与盐酸的体积比为_____________。
[答案]
23、双氧水(H2O2)和水都是极弱电解质,但H2O2比H2O更显酸性。
(1)若把H2O2看成是二元弱酸,请写出它在水中的电离方程式:_________________________。
(2)鉴于H2O2显弱酸性,它能同强碱作用形成正盐,在一定条件下也可形成酸式盐。请写出H2O2与Ba(OH)2作用形成正盐的化学方程式:______________________________。
(3)水电离生成H3O+和OH-叫作水的自偶电离。同水一样,H2O2也有极微弱的自偶电离,其自偶电离的方程式为____________________。
[答案]
24、(1)某温度下,纯水中的c(H+)=2.0×10-7mol·L-1,则此溶液中c(OH-)为___________ mol·L-1。若温度不变,滴入稀酸使c(H+)=5.0×10-6 mol·L-1,则由水电离产生的c(H+)=________ mol·L-1。
(2)室温下pH=2的某酸HnA(A为酸根)与pH=12的某碱B(OH)m 按一定体积混和,恰好反应生成正盐,混和溶液的 pH=8,反应所生成正盐的化学式为__________。该盐中__________离子一定能水解,其水解的离子方程式为__________________________。
[答案]
25、(7分)用实验确定某酸HA是弱电解质。两同学的方案是:
甲:①称取一定量的 HA配制0.1 mol·L-1的溶液100mL;
②用 pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的 HA溶液、盐酸,分别配制pH=1的两种酸溶液各100mL;
②分别取这两种溶液各 10mL,加水稀释为100mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明 HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是_____________。
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH____1(选填>、<、=)。
乙方案中,说明 HA是弱电解质的现象是________(多选扣分)。
A、装HCl溶液的试管中放出H2的速率快
B、装HA溶液的试管中放出H2的速度快
C、两个试管中产生气体速率一样快
(3)请你评价:乙方案中难以实现之处和不妥之处___________________。
(4)请你列举一种较好的方法:___________________________________。
[答案]
26、(8分)室温下将0.05 mol·L-1 H2SO4和未知浓度的NaOH溶液以体积比3:2混合,所得混合液pH为2。用上述NaOH溶液滴定pH为4的一元弱酸HA溶液20.00mL,当消耗掉25.00mL NaOH溶液时,反应达滴定终点,试求:
(1)NaOH溶液物质的量浓度。
(2)HA溶液物质的量浓度。
(3)室温时HA的电离常数。
[答案]
- 返回 -
|