|
一、电离平衡
1、电解质与非电解质
电解质和非电解质的本质差别是:在水溶液或熔化状态下,本身能否直接电离出离子的化合物。如酸、碱、盐属电解质, NH3、SO2、CO2,大部分有机物属非电解质。Cl2等单质既不是电解质也不是非电解质。
2、电解质导电条件
导电的物质不一定是电解质,电解质不一定导电。产生自由移动的离子是电解质导电的前提。电解质溶液导电能力的大小与自由移动离子浓度有关。
3、强电解质和弱电解质
强电解质和弱电解质的本质差别是:电解质在溶液中,被溶解的部分能否发生完全电离。电解质的强弱与电解质的溶解度无直接关系。
4、弱电解质的电离平衡
弱电解质的电离是一个可逆过程,如:
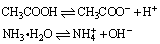
在一定条件下,电解质分子电离成离子的速率和离子重新结合成分子的速率相等时的状态,叫做电离平衡。
电离平衡是动态平衡,当条件改变时,平衡破坏,发生移动。
二、水的电离和溶液的pH值
1、水的电离
(1)水的电离平衡: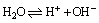 ,温度、酸、碱,能水解的盐等都能影响水的电离平衡。 ,温度、酸、碱,能水解的盐等都能影响水的电离平衡。
(2)水的离子积:一定温度下,稀溶液中Kw=c(H+)·c(OH-)。Kw只与温度有关,温度升高,Kw值增大。25℃时,Kw=1×10-14。
2、溶液的酸碱性和pH
pH=-lgc(H+),常温下pH=7中性,pH<7酸性,pH>7碱性。
3、有关pH的计算
要求溶液的 pH,我们始终要抓住一点,就是要找出溶液中H+的浓度。对于单一的溶液比较容易计算,若为溶液的混合,有这样的几种情况:
(1)两强酸混合,要抓H+物质的量来计算;
(2)两强碱混合,要抓OH-物质的量来计算;
(3)强酸强碱混合要抓过量的物质来计算。
三、盐类的水解

四、酸碱中和滴定

误差分析:如果酸HmR与碱M(OH)n完全中和,用酸标定碱,有:nHmR+mM(OH)n=MmRn+m·nH2O,设酸的物质的量浓度为C酸,消耗体积为V酸,碱的物质的量浓度为C碱,消耗体积为
V碱,则有mC酸·C酸=nC碱·V碱,即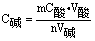 ,C酸当成标准溶液,V碱是待测碱液体积,计算时可看成不变量,这样,待测浓度是否准确,只取决于滴定管中读取的体积。引起这个体积误差的常用:①读数;②仪器洗涤;③滴定管漏液;④标准液不标准;⑤指示剂用错;⑥待测液的量取等。 ,C酸当成标准溶液,V碱是待测碱液体积,计算时可看成不变量,这样,待测浓度是否准确,只取决于滴定管中读取的体积。引起这个体积误差的常用:①读数;②仪器洗涤;③滴定管漏液;④标准液不标准;⑤指示剂用错;⑥待测液的量取等。
五、镁、铝及其化合物
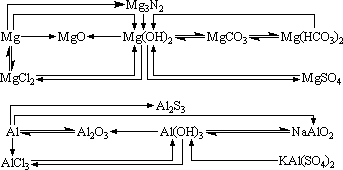
1、铝和强碱溶液反应,不是铝直接和碱反应,而是铝先和强碱溶液中的水反应生成氢氧化铝,然后氢氧化铝再和强碱反应生成偏铝酸盐。如铝与氢氧化钠溶液反应分两步进行:
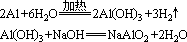
标电子转移时就可以更清楚地理解铝和氢氧化钠溶液反应的实质:
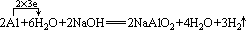
上式可简写为:
2Al+2H2O+2NaOH=2NaAlO2+3H2↑
2、氢氧化铝具有两性,可用电离平衡移动的原理来解释:氢氧化铝的电离方程式可表示如下:
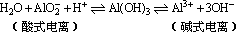
其电离程度相当微弱,只有加入强酸(或强碱)时,大量的H+(或OH-)才能破坏氢氧化铝的电离平衡,使平衡向右(或左)移动,生成铝盐(或偏铝酸盐),所以氢氧化铝既具有碱性,又具有酸性。当加入弱酸或弱碱时,因H+或OH-浓度太小,不能使上述平衡移动,因此Al(OH)3只溶于强酸或强碱,而不溶于弱酸或弱碱。
3、Al3+、Al(OH)3、AlO2-之间的转化关系。
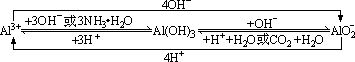
Al3+只能存在于酸性溶液中,AlO2-只能存在于碱性溶液中,若将两种溶液混合且适量将全部生成Al(OH)3沉淀。
4、镁与某些水解呈酸性的盐(如NH4Cl)溶液反应时,主要是镁与盐水解生成的酸发生置换反应产生H2。
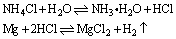
- 返回 -
|