N2(g)+3H2(g)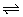 2NH3(g)
2NH3(g)
(1)若反应达到某时刻t时,nt(N2)=13 mol, nt(NH3)=6 mol,计算a的值。
(2)反应达平衡时,716.8L(标况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始) :n(平)=________。
(4)原混合气体中,a︰b=_____。
(5)达到平衡时,N2和H2的转化率之比,α(N2)︰α(H2)=_______。
(6)平衡混合气体中,n(N2)︰n(H2)︰n(NH3)=_______。
(1)反应某时刻t时,生成6 mol NH3要消耗3 mol N2,
故N2起始的物质的量为13 mol+3 mol=16 mol,即a=16 mol
(2)达到平衡后,混合气体的物质的量为:
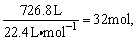 平衡时,n(NH3)=32 mol×25%=8 mol
平衡时,n(NH3)=32 mol×25%=8 mol
(3) N2 + 3H2  2NH3
2NH3
起始 a mol b mol 0
反应 (a-4)mol (b-12)mol 8 mol
故有 a-4+b-12+8=32 mol, 即a+b=40
所以 b = 24 mol
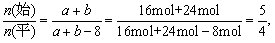
(4)前面已计算出混和气体中a=16 mol,b=24 mol,
所以a︰b=16︰24=2︰3
(5) N2 + 3H2 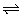 2NH3
2NH3
起始 16 24 0
转化 4 12 8
平衡 12 12 8
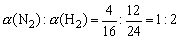
(6)平衡混合气体中:n(N2)︰n(H2)︰n(NH3)
=(a-4)︰(b-12)︰8=12︰12︰8=3︰3︰2