1.可逆反应N2+3H2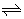 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是()
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是()
A.3v正(N2)=v正(H2)
B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v逆(NH3)
D.v正(N2)= 3v逆(H2)
2.在一定条件下,可逆反应N2+3H2 2NH3(正反应为放热反应),达到平衡,当单独改变下述条件后,有关叙述错误的是()
2NH3(正反应为放热反应),达到平衡,当单独改变下述条件后,有关叙述错误的是()
A.加催化剂,v正、v逆都发生变化,且变化的倍数相等
B.加压,v正、v逆都增大,且v正增大倍数大于v逆减小倍数
C.降温,v正、v逆都减小,且v正减小倍数大于v逆增小倍数
D.增大c(H2)的瞬间,v正、v逆都增大,且v正增大倍数大于v逆增大倍数
3.在一密闭容器内发生可逆反应:N2+3H2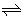 2NH3,在一定条件下达到平衡,若保持容器内温度不变,下列说法正确的是()
2NH3,在一定条件下达到平衡,若保持容器内温度不变,下列说法正确的是()
A.保持恒容,加入Ar,平衡不移动
B.保持恒压,加入Ar,平衡不移动
C.保持恒容,加入Ar,体系压强增大,平衡向正反应方向移动
D.保持恒压,加入Ar,平衡向逆反应方向移动
4.目前,我国合成氨工业的生产条件和措施主要有:①500℃左右的高温②以活性铁为主的多成分触煤③合成塔内压强在20Mpa~50Mpa ④生产过程中不断地用冷却法将氨从反应混合物中分离出来,并将N2、H2原料气送信合成塔循环使用。其中有利于提高合成氨日产量的是()
A.仅③④
B.除①外
C.除②外
D.①②③④
5.下列事实不能用勒沙特列原理来解释的是()
A.向饱和氯水中加NaOH,ClO-浓度增大
B.用H2O2和MnO2可以制O2
C.工业上合成氨选择温度是500℃
D.工业上合所氨及时将生成的NH3分离
6.以物质的量之比为2︰3的N2和H2在一定条件下反应,并达到平衡。在此过程中,下列说法正确的是()
A.在建立平衡的过程中N2和H2的物质的量之比始终是2︰3
B.N2的转化率始终为H2转化率的2倍
C.N2的转化率始终为H2转化率的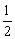
D.达到平衡时,平衡体系的总物质的量与起始时的总物质的量之比为1︰2
7.在一定温度下,N2(g)+3H2(g)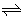 2NH3(g)达到平衡的标志是
2NH3(g)达到平衡的标志是
A.c(H2)︰c(N2)︰c(NH3)=3︰1︰2
B.每消耗1 mol N2必消耗3 mol H2生成2 mol NH3
C.N2减少的浓度是NH3浓度增加的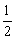 倍
倍
D.N2、H2和NH3的浓度不随时间变化而变化
8、在某合成氨厂合成氨的反应中,测得合成塔入口处的气体N2,H2、NH3的体积比为6:18:1,出口处气体N2、H2、NH3的体积比为9:27:8,则氮气的转化率为( )
A.75%
B.50%
C.25%
D.20%
9、将一定质量的Ag2SO4固体置于容积不变的容器中,某温度下发生下列反应: ,经10min后,反应达到平衡时,c(SO3)=0.4mol·L-1,c(SO2)=0.1mol·L-1,则下列陈述不正确的是( )
,经10min后,反应达到平衡时,c(SO3)=0.4mol·L-1,c(SO2)=0.1mol·L-1,则下列陈述不正确的是( )
A.SO3的分解率为20%
B.10min内v(O2)=0.005mol·L-1·min-1
C.容器内气体的密度为40g/L
D.加压,容器内固体的质量不变
10、将2molA 和1molB通入一密闭容器中,在某温度下达到平衡:
2A(气)+B(气) 2C(气)+D(气)。
2C(气)+D(气)。
经测定,平衡时混合气体中气体C的体积分数为24%,则B的转化率为( )
A.73%
B.36%
C.24%
D.12%