1、化学反应的活化能
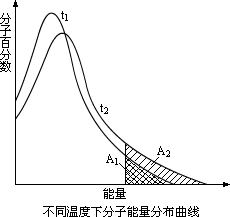
不同温度下分子能量分布是不同的。下图所示是不同温度下分子的能量分布示意图。当温度升高时,气体分子的运动速率增大,不仅使气体分子在单位时间内碰撞的次数增加,更重要的是由于气体分子能量增加,使活化分子百分数增大。图中曲线t1表示在t1温度下的分子能量分布,曲线t2表示在t2温度下的分子能量分布(t2>t1)。温度为t1时活化分子的多少可由面积A1反映出来;温度为t2时,活化分子的多少可由面积A1+A2反映出来。从图中可以看出,升高温度,可以使活化分子百分数增大,从而使反应速率增大。
2、为什么催化剂能加快化学反应速率
催化剂能够增大反应速率的原因,是它能够降低反应的活化能,从而使更多的反应物分子成为活化分子,大大增加单位体积内反应物分子中活化分子的百分数,成千成万倍地增大化学反应的速率。从如图所示中可以清楚地看出催化剂与反应速率的关系。
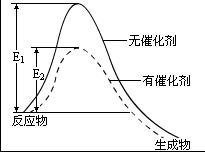
图中实线曲线表示不用催化剂时,反应物变成生成物的过程,E1是不用催化剂时的反应活化能;虚线曲线表示用催化剂时,反应物变成生成物的过程,E2是有催化剂存在时该反应的活化能。显然,使用催化剂能使反应的活化能降低,因而能大大增大反应的速率。这好像人们要翻越一座陡峭的高山,很费劲、很慢,能翻越的人就少些;如果在山下开凿一条隧道,穿过隧道就容易、就快,能穿过的人就多一样。
了解了上述概念后,我们才能正确认识外界条件的改变对化学反应速率的影响。
|