高考的命题主要集中在:
(1)利用化学反应速率的表达式直接进行计算;
(2)用反应物、生成物表示反应速率大小与化学计量数之间成正比关系进行计算;
(3)浓度、压强、温度以及是否使用催化剂,反应物表面积大小等外界条件对化学反应速率的影响;
(4)化学反应速率的大小与化学平衡移动的关系。
命题的热点是化学反应速率的计算及速率大小比较。今后命题方向是用影响化学反应速率的外在因素选择反应条件,或者给定某一反应速率与时间的变化曲线图像,提出合理的解释。
例1、(北京)一定条件下,在密闭容器中,能表示反应X(气)+2Y(气) 2Z(气)一定达到化学平衡状态的是( ) 2Z(气)一定达到化学平衡状态的是( )
①的物质的量之比为1︰2︰2
②X、Y、Z的浓度不再发生变化
③容器中压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y
A.①② B.①④
C.②③ D.③④
答案:C
解析:
x、y的消耗速率与z的生成速率比为1︰2︰2,达到平衡后,x、y、z的物质的量之比与反应前投入到容器中各物质的量有关,故①错;x、y、z的浓度不变时表明反应达到化学平衡状态,②正确;x(气)+2y(气) 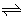 2z(气)正反应气体的物质的量减小,容器压强不变亦可表明反应达到化学平衡状态,③正确;达到化学平衡状态后单位时间内生成n mol z,则同时生成n mol y,故④不是化学平衡状态,答案为C。 2z(气)正反应气体的物质的量减小,容器压强不变亦可表明反应达到化学平衡状态,③正确;达到化学平衡状态后单位时间内生成n mol z,则同时生成n mol y,故④不是化学平衡状态,答案为C。
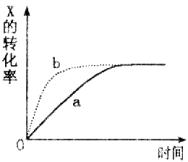
例2、(广东)下图曲线a表示放热反应X(g)+Y(g)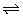 Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件使反应过程按b曲线进行,可采取的措施是( ) Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件使反应过程按b曲线进行,可采取的措施是( )
A.升高温度 B.加大X的投入量
C.加催化剂 D.增大体积
答案:C
解析:
从图中可看出,改变条件,只是加快了反应速率,缩短了达到平衡的时间,X的转化率不变,A选项升高温度,X的转化率减小,B选项也使X转化率减小,D选项减小气体物质的浓度,减慢了反应速率,延长了达到平衡的时间。
|