|
本试卷分第Ⅰ卷和第Ⅱ卷共100分,考试时间90分钟。
第Ⅰ卷(选择题,共49分)
一、选择题(本题包括5小题,每小题2分共10分。每小题只有一个选项符合题意。)
1、一定条件下,反应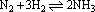 在2L的容器中进行,5min内氨的质量增加1.7g,则这在这段时间内的反应速率是( ) 在2L的容器中进行,5min内氨的质量增加1.7g,则这在这段时间内的反应速率是( )
A.V(NH3)=0.17g·L-1·s-1 B.V(NH3)=0.02mol·L-1·min-1
C.V(N2)=0.01mol·L-1·s-1 D.V(H2)=0.015mol·L-1·min-1
2、在温度一定时,压强分别为P1、P2的条件下,A(g)+2B(g) 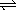 nc(g)的反应体系中,C的体积分数与时间t,压强P1、P2的关系如图所示,则下列结论正确的是( ) nc(g)的反应体系中,C的体积分数与时间t,压强P1、P2的关系如图所示,则下列结论正确的是( )
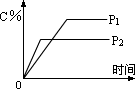
A.P1>P2,n<3 B.P1<P2,n=3
C.P1<P2,n=3 D.P1>P2,n>3
以下3—5题是关于合成氨工业生产方面的几个问答题。
3、生产合成氨原料气通常所用的原料是( )
A.氮和氢气 B.空气、煤和水
C.FeS2和空气 D.煤、氧气、水蒸气
4、利用原料气在合成塔中合成氨时,为提高N2的转化率所采取的措施有( )
A.高温 B.高压
C.使用催化剂 D.增大N2的浓度
5、在合成氨工业中采用450℃~500℃温度是为了( )
A.加快化学反应速率 B.提高N2的转化率
C.使平衡向生成NH3的方向移动 D.有利于NH3的分解
二、选择题(本题包括8小题,每小题2分共16分。每小题有一个或两个选项符合题意)
6、下列反应在四个容积固定的密闭容器中进行,在达到平衡后,其混合气的密度和平均相对分子质量都增大的是(假定反应均从正反应开始)( )
 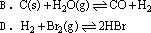
7、在一定体积的密闭容器中放入3L气体R和5L气体Q,在一定条件下发生反应:
2R(气)+5Q(气)=4X(气)+nY(气)
反应完全后,容器温度不变,混合气体的压强是原来的87.5%,则化学方程式中的n值是( )
A.2 B.3
C.4 D.5
8、已知工业上真空炼铷的原理如下: 
对于此反应的进行能给予正确解释的是( )
A.铷的金属活动性不如镁强,故镁可置换铷
B.铷的沸点比镁低,把铷蒸气抽出时,平衡右移
C.MgCl2对热稳定性不如RbCl强
D.铷的单质状态较化合态更稳定
9、在一定条件下,反应2A(气)+2B(气) 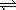 3C(气)+D(气)达到平衡状态的标志是( ) 3C(气)+D(气)达到平衡状态的标志是( )
A.单位时间内生成2n mol A,同时生成n mol D
B.容器内压强不随时间而变化
C.单位时间内生成n mol B,同时消耗1.5n mol C
D.容器内混合气体密度不随时间而变化
10、丁烷可发生下列分解反应并建立平衡:
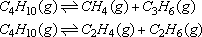
将2mol丁烷放入密闭容积中,达到平衡时,丁烷的分解率为25%,则平衡混合气时对氦气的相对密度为( )
A.29 B.14.5
C.11.6 D.5.8
11、下图表示外界条件(温度、压强)的变化,对下列反应的影响L(S)+G(g) 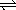 2R(g)-Q,在图中,y轴是指( ) 2R(g)-Q,在图中,y轴是指( )
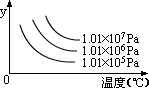
A.平衡混合气中R的百分含量 B.平衡混合气中G的百分含量
C.G的转化率 D.L的转化率
12、已知可逆反应:aA+bB  cC物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是( ) cC物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是( )
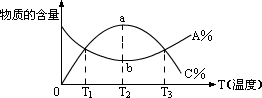
A.该反应于T1、T3温度曾达到过化学平衡
B.该反应于T2温度时曾达到过化学平衡
C.该反应的正反应是放热反应
D.该反应的正反应是吸热反应
13、mA(固)+nB(气)  pC(气)+Q(Q>0)的可逆反应在室温条件下B%与压强(P)的关系如图所示,则有关叙述正确的是( ) pC(气)+Q(Q>0)的可逆反应在室温条件下B%与压强(P)的关系如图所示,则有关叙述正确的是( )
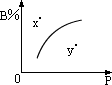
A.m+n<p B.n>p
C.X点时混合物V正>V逆 D.X点比Y点混合物反应速率快
三、选择题(本题包括5小题,每小题3分共15分。每小题只有一个选项符合题意)
14、一定条件下,在容积为2L的密闭容器中。加入一定量的A,发生如下反应并建立平衡:
A(g)  2B(g) 2B(g) 2B(g) 2B(g) 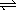 C(g)+2D(g) C(g)+2D(g)
测得平衡时各物质的浓度是:
C(A)=0.3mol·L-1,C(B)=0.2mol·L-1,C(C)=0.05mol·L-1
求最初向容器内加入A的物质的量是( )
A.0.8mol B.0.5mol
C.0.9mol D.1.2mol
15、关于平衡体系:mA(g)+nB(g) 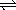 pC(g)+qD(g)+Q,若升高温度,下列图象如图所示能正确反映变化过程的是(纵坐标表示反应速率V,横坐标表示时间t)( ) pC(g)+qD(g)+Q,若升高温度,下列图象如图所示能正确反映变化过程的是(纵坐标表示反应速率V,横坐标表示时间t)( )

16、NO2溶于水制硝酸的反应:3NO2(g)+H2O(l) 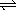 2HNO3+NO(g)+Q,为了提高硝酸的产率,硝酸厂实际生产中均采用的措施是( ) 2HNO3+NO(g)+Q,为了提高硝酸的产率,硝酸厂实际生产中均采用的措施是( )
A.升温 B.加压
C.通入过量氧气 D.降温
17、在两体积固定且相同的密闭容器A、B中,保持温度为423K,同时向A、B中分别加入amol和bmol碘化氢(a>b),待反应2HI  H2+I2(g)达到平衡状态后,下列说法正确的是( ) H2+I2(g)达到平衡状态后,下列说法正确的是( )
A.从反应开始达平衡所需时间tA>tB
B.平衡时I2的浓度c(I2)A=c(I2)B
C.平衡时I2蒸气在混合气体中体积分数A%>B%
D.HI的平衡分解率αA=αB
18、在一密闭容器中进行X2(g)+3Y2(g) 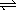 2Z(g)的反应,其中X2、Y2、Z的起始浓度依次为0.1 mol·L-1、0.3mol·L-1、0.2mol·L-1,当反应达到平衡时,各物质的浓度有可能是( ) 2Z(g)的反应,其中X2、Y2、Z的起始浓度依次为0.1 mol·L-1、0.3mol·L-1、0.2mol·L-1,当反应达到平衡时,各物质的浓度有可能是( )
A.c(Z)=0.5 mol·L-1
B.c(Y2)=0.5 mol·L-1 或 0.1 mol·L-1
C.c(Z)=0.4 mol·L-1
D.c(X2)=0.2 mol·L-1 或 c(Y2)=0.6 mol·L-1
[提示]
第Ⅱ卷(非选择题,共51分)
四、(本题包括两小题,共13分)
19、已知氯水中有如下平衡:Cl2+H2O  HCl+HClO HCl+HClO
常温下,在一个体积为50mL的针筒里吸入40mL氯气后,再吸进10mL水。写出针筒中可能观察到的现象________________。
若将此针筒长时间放置,又可能看到何种变化________________;试用平衡观点加以解释________________________。
20、①将FeCl3和KSCN的稀溶液各2mL混合,可观察到的现象是______________,有关反应的化学方程式:__________________________,将所得混合液分为两等份。分别进行如下实验
②向其中一份中滴加几滴FeCl3浓溶液,溶液颜色明显加深,这表明原溶液中一定有________没有反应完。
③向另一份中滴加几滴KSCN浓溶液,溶液颜色也明显加深,这表明原溶液中一定有________没有反应完。
在上面实验中,足以证明FeCl3溶液与KSCN溶液的反应是可逆的步骤是( )
A、① B、①②
C、①③ D、①②③
由该实验还可得出的结论是:_______________________________。
[答案] 五、(本题包括两小题,共12分)
21、在10℃和2×105Pa的条件下,反应aA(g) 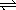 dD(g)+eE(g)建立平衡后,再逐步增大体系的压强(温度维持不变)。下表列出了不同压强下反应建立平衡时物质D的浓度。 dD(g)+eE(g)建立平衡后,再逐步增大体系的压强(温度维持不变)。下表列出了不同压强下反应建立平衡时物质D的浓度。
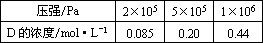
根据表中数据,回答下列问题:
(1)压强从2×105Pa增加到5×105Pa时,平衡向_______(填“正”“逆”)反应方向移动,理由是________________________________。
(2)压强从5×105Pa增加到1×106Pa时,平衡向_______(填“正”“逆”)反应方向移动,理由是________________________________。
22、将等物质的量的A、B、C、D四种物质混合,发生如下反应:
aA+bB  cC(固)+dD cC(固)+dD
当反应进行一定时间后,测得A减少了n mol,B减少了 mol,C增加了 mol,C增加了 n mol,D增加了n mol,此时达到化学平衡。 n mol,D增加了n mol,此时达到化学平衡。
(1)该化学方程式中各物质的系数为:a=_____,b=_____,c=_____,d=_____。
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中各物质的聚集状态为A__________,B_________,D_________。
(3)若只升高温度,反应一段时间后,测知四种物质的量又达到相等,则该反应为_________反应(填放热或吸热)。
[答案]
六、(本题包括两小题,共12分)
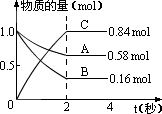
23、某温度下,在5.0L的密闭容器中,A、B、C三种气态物质的物质的量随时间变化的曲线如图所示,则它们之间的反应方程式为(用A、B、C表示)_________________。从反应开始到平衡建立这段时间里,反应的平均速率VB=_____mol·L-1·s-1,VC=_____mol·L-1·s-1。
24、已知某可逆反应mA(g)+nB(g)  pC(g)+Q在密闭容器中进行,如图所示在不同反应时间t时,温度T和压强P与物质B在混合气中的体积分数V(B)%的关系曲线,试回答有关问题: pC(g)+Q在密闭容器中进行,如图所示在不同反应时间t时,温度T和压强P与物质B在混合气中的体积分数V(B)%的关系曲线,试回答有关问题:
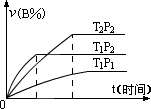
(1)开始时,充入该容器的气体一定有________,一定没有________;
(2)温度T1与T2的相对高低为_________,理由是________________。
(3)压强P1与P2的相对大小为_________,理由是________________。
(4)上述反应方程式中的Q值(大于、小于、等于)___________零。
(5)上述反应方程式中m、n与p的相对大小关系为m+n_________。
[答案]
七、(本题包括两小题,共14分)
25、将等物质的量的A、B混合于2L的密闭容器中发生如下反应:3A(气)+B(气) 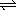 XC(气)+2D(气),经5min后,测得D浓度为0.5mol·L-1,[A]:[B]=3:5,C的平均反应速率是0.1mol·L-1·min-1,求: XC(气)+2D(气),经5min后,测得D浓度为0.5mol·L-1,[A]:[B]=3:5,C的平均反应速率是0.1mol·L-1·min-1,求:
(1)此时A的浓度及反应开始前放入容器中A、B的物质的量。
(2)B的平均反应速率。
(3)X的值。
[答案]
26、某温度下在1L密闭容器中加入1mol N2和3mol H2,使反应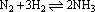 达平衡。测得平衡混合气体中N2、H2、NH3的浓度分别为M、N、G mol/L。如果温度不变,只改变初始物质的加入量,而要求M、N、G总保持不变,则N2、H2、NH3的加入量用x、y、z表示时,应满足的条件是: 达平衡。测得平衡混合气体中N2、H2、NH3的浓度分别为M、N、G mol/L。如果温度不变,只改变初始物质的加入量,而要求M、N、G总保持不变,则N2、H2、NH3的加入量用x、y、z表示时,应满足的条件是:
①若x=0,y=0,则z=________。
②若x=0.75mol,则y=________,z=________。
③x、y、z取值必须满足一般条件是(用含x、y、z的方程表示)其中一个含x、z,另一个含y、z:_____________。
若将上述条件改为恒温、恒压,其它均不变。则:
a.若x=0,y=0,则z=________。
b.若x=0.75mol,则y=________,z=_________。
c.x、y、z取值必须满足的一般条件是___________________。
[答案]
- 返回 -
|







