例1、(全国卷)、已知反应A2(g)+2B2(g)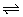 2AB2(g)的△H < 0,下列说法正确的是( ) 2AB2(g)的△H < 0,下列说法正确的是( )
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
答案:B
解析:
A2(g)+2B2(g)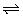 2AB2(g),△H<0,则说明正反应为放热反应。升高温度,正、逆反应速率都增大,达到平衡的时间缩短;A错B对;升高温度平衡向逆向移动,增大压强平衡向正向移动,相反降低温度平衡向正向进行 ,减小压强平衡向逆向进行,故答案为B。 2AB2(g),△H<0,则说明正反应为放热反应。升高温度,正、逆反应速率都增大,达到平衡的时间缩短;A错B对;升高温度平衡向逆向移动,增大压强平衡向正向移动,相反降低温度平衡向正向进行 ,减小压强平衡向逆向进行,故答案为B。
例2、(广东)、在一定条件下,固定容积的密闭容器中反应:2NO2(g)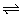 O2(g)+2NO(g); △H>0,达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是( ) O2(g)+2NO(g); △H>0,达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是( )
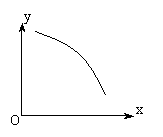
A.当X表示温度时,Y表示NO2的物质的量
B.当X表示压强时,Y表示NO2的转化率
C.当X表示反应时间时,Y表示混合气体的密度
D.当X表示NO2的物质的量时,Y表示O2的物质的量
答案:AB
解析:
若x表示温度,则随温度升高,平衡向正反应方向移动,NO2物质的量减少,A正确;若x表示压强,则随压强增大,平衡向逆反应方向移动,NO2转化率减小,B正确;若x表示反应时间,混合气体的密度应保持一条直线不变,C错误;若x表示NO2的物质的量,则随固定容器中NO2物质的量增加,O2的物质的量也应在一定了限度内增加,D错误,故选AB。
|