与O2反应4P+5O2 2P2O5(白色固体)
2P2O5(白色固体)
与Cl2反应2P+3Cl2 2PCl3(无色液体)
2PCl3(无色液体)
2P+5Cl2 2PCl5(白色固体)
2PCl5(白色固体)
与其它强的氧化剂反应2P+5H2SO4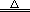 2H3PO4+5SO2↑+2H2O
2H3PO4+5SO2↑+2H2O
4、磷的用途
(1)白磷和红磷都可用于制纯度较高的H3PO4
(2)白磷可用于制造烟幕弹和燃烧弹等
(3)红磷可用于制农药、安全火柴等
(二)磷酸
1、物理性质
纯净磷酸是无色透明的晶体,难挥发,具有吸湿性。常用的浓磷酸是含83~98%H3PO4的无色稠液体。
2、化学性质
磷酸是三元中强酸,分三步电离
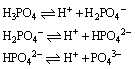
磷酸属非氧化性酸,具有酸的通性
(1)与碱反应
NaOH+H3PO4=NaH2PO4+H2O
2NaOH+H3PO4=Na2HPO4+2H2O
3NaOH+H3PO4=Na3PO4+3H2O
(2)与某些盐反应
NaBr+H3PO4(浓) 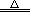 NaH2PO4+HBr↑
NaH2PO4+HBr↑
NaI+H3PO4(浓)  NaH2PO4+HI↑
NaH2PO4+HI↑
原理:难挥发性酸制挥发性酸
3、工业制法
方法一:Ca3(PO4)2+3H2SO4(浓)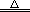 3CaSO4↓+2H3PO4
3CaSO4↓+2H3PO4
方法二:4P+5O2 2P2O5
2P2O5
P2O5+3H2O  2H3PO4
2H3PO4
或3P4+2OHNO3(稀)+8H2O=12H3PO4+2ONO↑
(三)磷酸盐
磷酸盐有三类:正盐(含PO43-)、磷酸一氢盐(含HPO42-)、
磷酸二氢盐(含H2PO4-)。三类盐之间的转化关系为
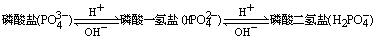
1、溶解性规律
正盐和一氢盐:除钾、钠、铵等少数盐外,其余都难溶于水,但能溶于强酸。
二氢盐:都易溶于水。
2、相互转化
往澄清石灰水中逐滴滴加H3PO4,边滴边振荡。
现象:开始有白色沉淀生成,而后逐渐溶解。
反应方程式:
3Ca(OH)2+2H3PO4=Ca3(PO4)2↓+6H2O
Ca3(PO4)2+H3PO4=3CaHPO4
CaHPO4+H3PO4=Ca(H2PO4)2
往磷酸溶液中逐滴滴加澄清石灰水,边滴加振荡。
现象:开始无现象,当澄清石灰水滴到一定量时,有白色沉淀生成。
反应方程式:
Ca(OH)2+2H3PO4=Ca(H2PO4)2+2H2O
Ca(H2PO4)2+Ca(OH)2=2CaHPO4↓
2CaHPO4+Ca(OH)2=Ca3(PO4)2+2H2O
3、离子共存的问题
(1)H2PO4-、HPO42-、PO43-与H+不能共存
(2)H2PO4-、HPO42-与OH-不能共存
(3)H2PO4-与PO43-不能共存
H2PO4-+PO43-=2HPO42-
(4)H2PO4-与HPO42-、HPO42-与PO43-可共存
4、磷肥的制取和使用
制磷肥的目的是把不溶性的磷酸盐,转化为可溶性的磷酸二氢盐,便于植物吸收。
制取:

重钙
使用:
磷肥不能与碱性物质混合使用,以免把可溶性的磷酸二氢盐转化为难溶的磷酸盐。
5、PO43-的检验
若在待测液中滴加AgNO3溶液,有黄色沉淀生成,再滴入稀HNO3,黄色沉淀溶解,则可证明原溶液中含有PO43-。
若待测液呈酸性,则应先在待测液中滴氨水至中性,再滴加AgNO3溶液和稀HNO3。