4、在一支25mL的酸式滴定管中盛入0.1 mol· L-1HCl溶液,其液面恰好在5 mL的刻度处,若把滴定管中的溶液全部放入烧杯中,然后以0.1 mol·L-1NaOH溶液进行中和,则所需NaOH溶液的体积( )
A.大于20mL
B.小于20mL
C.等于20mL
D.等于5mL
5、将ag含NaOH样品溶解在b mL 0.1 mol·L-1的硫酸中,再加入c mL 0.1 mol·L-1氢氧化钡溶液,反应后所得溶液恰好呈中性,则样品中NaOH的纯度是(NaOH式量为40)( )
A. 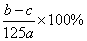 B.
B. 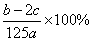
C. 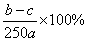 D.
D. 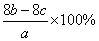
6、以下是几种酸碱指示剂变色的pH范围:①甲基橙3.1~4.4②甲基红4.4~6.2③酚酞8.2~10, 现用0.1000 mol·L-1NaOH溶液滴定浓度相近的甲酸时,上述指示剂( )
A.都可以用
B.只能用③
C.可以用①或②
D.可以用②或③
7、称量一定质量的NaOH固体配成标准溶液,去滴定未知物质的量浓度的盐酸(甲基橙作指示剂)时,下列情况会使测定结果偏低的是( )
A.用含NaCl杂质的NaOH配制标准溶液来滴定盐酸
B.用含Na2O杂质的NaOH配制标准溶液来滴定盐酸
C.用含Na2CO3杂质的NaOH配制标准溶液来滴定盐酸
D.用含NaHCO3杂质的NaOH配制标准溶液来滴定盐酸
8、等物质的量的苛性钠溶液分别用pH为2和3的醋酸中和,设消耗醋酸溶液的体积依次为Va、Vb,则两者的关系正确的是( )
A.Va>10Vb
B.Va=10Vb
C.Vb<10Va
D.Vb>10Va
9、25℃时,向VmL pH=a的盐酸中,滴加pH=b的NaOH溶液10V mL时,溶液中c(Cl-)=c(Na+),则此时a+b为( )
A.13
B.14
C.15
D.不能确定
10、用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,下列实验操作会引起测量结果偏高的是( )
①用天平称量NaOH固体,将小烧杯放在右盘,砝码放在左盘,并移动游码,使之平衡。
②配制烧碱溶液时,将称量后的NaOH固体溶于水,立即移入容量瓶,将洗涤烧杯的液体注入容量瓶后,加蒸馏水至刻度线。
③中和滴定时,锥形瓶内有少量水。
④酸式滴定管用蒸馏水洗后,未用标准液洗。
⑤读取滴定管终点读数时,仰视刻度线。
A.①②③
B.②④⑤
C.③④⑤
D.①②③④⑤