Fe3+的性质归纳
1、特殊的颜色
Fe3+在无水时呈淡紫色,在水溶液中以六水合铁(Ⅲ)离子[Fe(H2O)6]3+形式存在而呈黄色,在结晶水合物中如FeCl3·6H2O,也以[Fe(H2O)6]3+形式存在,而使晶体呈棕褐色。
2、水解性
(1)Fe3+半径小,所带电荷多,水解程度较大。
在常温下,
在沸水中,Fe3++3H2O(沸水)=Fe(OH)3(胶体)+3H+。
(2)当Fe3+遇到HCO3-、CO32-、AlO2-等离子时,水解完全:Fe3++3HCO3-=Fe(OH)3↓+3CO2↑
(3)将FeCl3溶液蒸发,灼烧后得Fe2O3原因是:加热水解平衡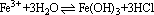 向正反应方向移动,HCl挥发使水解完全,得到Fe(OH)3。灼烧发生下列反应:
向正反应方向移动,HCl挥发使水解完全,得到Fe(OH)3。灼烧发生下列反应: 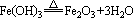 ,故得Fe2O3。
,故得Fe2O3。
(4)Fe3+只能存在于pH<3.7的酸性溶液中,当pH≥3.7时,它就会形成Fe(OH)3而析出沉淀。
3、较强的氧化性
(1)Fe3+的氧化性在金属阳离子中是比较强的,其氧化性强于H+、Cu2+等,但弱于Ag+。
(2)Fe3+的氧化性强于I2,而弱于Br2。
(3)Fe3+表现氧化性的反应有:
2Fe3++Fe=3Fe2+
2Fe3++Cu=2Fe2++Cu2+
2Fe3++H2S=S↓+2Fe2++2H+
2Fe3++2I-=2Fe2++I2
2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
2Fe3++S2-=2Fe2++S↓
4、络合反应
Fe3++3SCN-=Fe(SCN)3,红色溶液
Fe3++6C6H5OH=[Fe(C6H5O)6]3-+6H+,显紫色(可用于检验Fe3+的存在)。
(苯酚)