1.(江苏)下列叙述不正确的是( )
A.硝酸银溶液通常保存在棕色的试剂瓶中,是因为硝酸银见光易分解
B.乙醇的沸点比甲醚(CH3OCH3)高,主要原因是乙醇分子间能形成氢键
C.反应AgCl+NaBr=AgBr+NaCl能在水溶液中进行,是因为AgBr比AgCl更难溶于水
D.常温下浓硫酸可贮存于铁制或铝制容器中,说明常温下铁和铝与浓硫酸不反应
2.(上海)下列金属冶炼的反应原理,错误的是( )
A.2NaCl(熔融) 2Na+Cl2
B.MgO+H2
2Na+Cl2
B.MgO+H2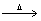 Mg+2H2O
Mg+2H2O
C.Fe3O4+CO  3Fe+4CO2
D.2HgO
3Fe+4CO2
D.2HgO 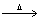 2Hg+O2
2Hg+O2
3.(江苏)下列除去杂质的实验方法正确的是( )
A.除去CO中少量O2:通过灼热的Cu网后收集气体
B.除去K2CO3固体中少量NaHCO3:置于坩埚中加热
C.除去苯中溶有的少量苯酚:加入稍过量浓溴水反应过滤
D.除去FeCl3酸性溶液中少量的FeCl2:加入稍过量双氧水后放置
4.(天津)下列除杂质的方法不可行的是( )
A.用过量氨水除去Al3+溶液中的少量Fe3+
B.将混合气体通过灼热的铜网除去N2中少量O2
C.用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水
D.用盐酸除去AgCl中少量的Ag2CO3
5.(上海)某500 mL溶液中含0.1 mol Fe2+、0.2 mol Fe3+,加入0.2 mol铁粉,待Fe3+完全还原后,溶液中Fe2+的物质的量浓度为(假设反应前后体积不变)( )
A.0.4 mol / L
B.0.6 mol / L
C.0.8 mol / L
D.1.0 mol / L
6. 在强酸溶液中,下列各组离子能够大量共存的是( )
A.Mg2+、Ca2+、HCO3-、Cl-
B.Na+、AlO2-、Cl-、SO42-
C.K+、Fe2+、SO42-、Br-
D.Fe2+、Ca2+、Cl-、NO3-
7、某溶液里加入过量氨水或过量的NaOH溶液均有沉淀产生,若加入铁粉或铜粉,溶液质量都增加,则溶液里一定含有下列中的( )
A.Al3+
B.Fe2+
C.Fe3+
D.Cu2+
8、久置空气中的下列物质,因被氧化而呈黄色的是( )
A.浓硝酸
B.氯化亚铁溶液
C.Na2SO3
D.Na2SiO3
9、将FeCl3溶液蒸干并灼烧,最后得到的固体产物是( )
A.无水FeCl3
B.Fe(OH)3
C.Fe2O3
D.FeO
10、根据反应式①2Fe3++2I-=2Fe2++I2 ②Br2+2Fe2+=2Br-+2Fe3+,可判断离子的还原性从强到弱的顺序是( )
A.Br-、Fe2+、I-
B.I-、Fe2+、Br-
C.Br-、I-、Fe2+
D.Fe2+、I-、Br-