1、下列叙述正确的是( )
A.氯化钠溶液在电流的作用下电离成钠离子和氯离子
B.溶于水后能电离出氢离子的化合物都是酸
C.硫酸钡难溶于水,但硫酸钡属于强电解质
D.二氧化碳的水溶液能微弱导电,故CO2是弱电解质
2、将0.1mol·L-1的CH3COOH溶液稀释10倍,下列微粒浓度减小得最多的是( )
A.CH3COO- B.OH-
C.H+ D.CH3COOH
3、甲、乙两瓶氨水的浓度分别为1mol·L-1和0.1mol·L-1,则甲、乙两瓶氨水中c(OH-)之比为( )
A.大于10 B.小于10
C.等于10 D.无法确定
4、将纯水加热至较高温度,下列叙述正确的是( )
A.水的离子积变大,pH变小,呈酸性
B.水的离子积不变,pH不变,呈中性
C.水的离子积变小,pH变大,呈碱性
D.水的离子积变大,pH变小,呈中性
5、在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和pH都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气.下列说法正确的是( )
A.甲烧杯中放入锌的质量比乙烧杯中放入锌的质量大
B.甲烧杯中的酸过量
C.两烧杯中参加反应的锌等量
D.反应开始乙烧杯中的c(H+)始终比甲烧杯中的c(H+)小
6、将pH=3的强酸溶液和pH=12的强碱溶液混合,当混合后的pH=11时,强酸与强碱溶液的体积比是( )
A.2︰5 B.1︰10
C.9︰l D.9︰2
7、将pH=1的盐酸平均分成两份,一份加适量水,另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比约为( )
A.9 B.10
C.11 D.12
8、下列叙述正确的是( )
A.0.1mol·L-1氨水中,c(OH-)=c(NH4+)
B.10mL 0.02mol·L-1 HCl溶液与10mL 0.02mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=12
C.在0.1mol·L-1 CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
D.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
9、25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是( )
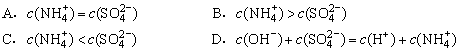
10、相同物质的量浓度的NaCN和NaClO相比,NaCN溶液的pH值较大,则对同温同体积同浓度的HCN和HClO的说法正确的是( )
A.相同条件下HCN比HClO易电离
B.pH:HClO>HCN
C.与NaOH恰好完全反应时,消耗NaOH物质的量HClO>HCN
D.酸根离子浓度c(CN-)<c(ClO-)
11、在pH=9的KOH和NaCN两种溶液中,设由水电离产生的OH-浓度分别为M mol·L-1和N mol·L-1,则M和N的关系为( )
A.M>N B.M=10-4·N
C.N=10-4M D.M=N
12、某酸HX稀溶液和某碱YOH稀溶液的物质的量浓度相等,两溶液混合后,溶液的pH大于7,下表中判断合理的是( )
编号 |
HX |
YOH |
溶液的体积关系 |
① |
强酸 |
强碱 |
V(HX)=V(YOH) |
② |
强酸 |
强碱 |
V(HX)<V(YOH) |
③ |
强酸 |
弱碱 |
V(HX)=V(YOH) |
④ |
弱酸 |
强碱 |
V(HX)=V(YOH) |
A.①③ B.②③
C.①④ D.②④
13、室温时,下列混合溶液的pH一定小于7的是( )
A.pH=3的盐酸和pH=11的氨水等体积混合
B.pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合
C.pH=3的醋酸和PH=11的氢氧化钡溶液等体积混合
D.pH=3的硫酸和pH=11的氨水等体积混合
14、为配制Na2S溶液中存在的下列关系中不正确的是( )
A.c(Na+)=2c(S2-)+2c(HS-)+2(H2S)
B.c(Na+)+c(H+)=c(OH-)+c(HS-)+c(S2-)
C.c(OH-)=c(H+)+c(HS-)+2c(H2S)
D.c(Na+)>c(S2-)>c(OH-)>c(HS-)
15、为配制NH4+的浓度与Cl-的浓度之比为1︰1的溶液,可在NH4Cl溶液中加入:①适量的盐酸;②适量的NaCl;③适量的氨水;④适量的NaOH.其中正确的是( )
A.①② B.③
C.③④ D.④
16、准确移取25.00mL某未知浓度的盐酸溶液于一洁净锥形瓶中,然后用0.20mol·L-1 NaOH溶液滴定(指示剂为酚酞).滴定结果如下:
| |
NaOH溶液起始读数 |
NaOH溶液终点读数 |
第一次 |
0.05mL |
18.78mL |
第二次 |
0.20mL |
18.96mL |
(1)根据以上数据可计算出盐酸的物质的量浓度为__________mol·L-1.(精确到0.01)
(2)如标准NaOH溶液由于保存不妥而变质(和空气中CO2反应产生少量Na2CO3),测出的盐酸浓度________(填“偏高”“偏低”或“不变”).
(3)若操作有误,则导致待测盐酸溶液浓度偏低的错误操作是________(填序号).
A.滴定管用蒸馏水洗后未用标准碱液润洗,直接装入标准碱液
B.滴定前滴定管端有气泡,滴定后气泡消失
C.滴定管读数时,滴定前仰视滴定后俯视
D.待测液中指示剂酚酞(为有机弱酸)加得太多
(4)如果准确移取25.00mL 0.20mol·L-1 NaOH溶液于锥形瓶中,滴入酚酞指示剂,然后用未知浓度的盐酸(装在酸式滴定管中)滴定,是否也可测定出盐酸的物质的量浓度?________(填“是”或“否”).
17、今有a.盐酸;b.硫酸;c.醋酸三种酸:
(1)在同体积,同pH的三种酸中,分别加入足量的碳酸钠粉末,在相同条件下产生CO2的体积由大到小的顺序是________________.
(2)在同体积、同物质的量浓度的三种酸中,分别加入足量的碳酸钠粉末,在相同条件下产生CO2的体积由大到小的顺序是________________.
(3)物质的量浓度为0.1mol·L-1的三种酸溶液的pH由大到小的顺序是________;如果取等体积的0.1mol·L-1的三种酸溶液,用0.1mol·L-1的NaOH溶液中和,当恰好完全反应时,消耗NaOH溶液的体积由大到小的顺序是________.(以上均用酸的序号填写)
18、在FeCl3溶液中存在下列平衡: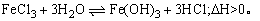
(1)加热FeCl3溶液,溶液颜色会不断加深,可得到一种红褐色的透明液体,向这种溶液中加入MgCl2溶液,产生的现象是__________.
(2)不断加热FeCl3溶液,蒸干并灼烧,得到的固体为__________,其理由是__________.
(3)在配制FeCl3溶液时,为防止浑浊,应加入______________________________.
(4)在FeCl3溶液中加入一定量Na2CO3溶液,产生的现象是____________________,有关反应的离子方程式为:____________________.
20、有pH=13的Ba(OH)2与NaOH的混合溶液100mL.取出25mL用0.05mol·L-1的H2SO4滴定,当滴定到沉淀不再增加时,所消耗酸的体积是滴定至终点所消耗酸的体积的一半.试求:
(1)当滴定至沉淀不再增加时,溶液的pH值(设体积等于两者之和);
(2)原混合溶液中Ba(OH)2与NaOH的物质的量浓度.