一、选择题
1、关于氮族元素的叙述正确的是( )
A.它们的单质在常温下都难以与H2化合
B.它们的单质的熔沸点从氮到铋依次升高
C.它们最高价含氧酸的化学式都可用H3RO4表示
D.它们最高价氧化物对应的水化物都是强酸
2、下列做法正确的是( )
A.将浓硝酸保存在无色玻璃瓶中
B.用镊子取出白磷并置于水中切割
C.把氯酸钾制氧气后的残渣倒入垃圾桶
D.氢气还原氧化铜实验先加热再通氢气
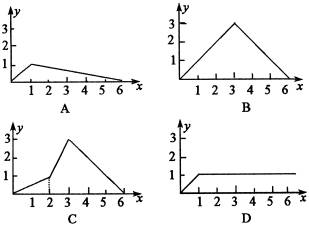
3、向澄清石灰水中逐渐加入稀H3PO4溶液直至过量,下列曲线中能正确表示生成沉淀的物质的量(y)和所加H3PO4的物质的量(x)的关系是( )
4、在一定条件下将a体积NO2和b体积O2同时通入倒立于水中且盛满水的容器内充分反应后,容器内残留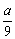 体积气体,该气体遇空气变红棕色,则a与b的比值为( ) 体积气体,该气体遇空气变红棕色,则a与b的比值为( )
A.6︰1 B.1︰6
C.8︰3 D.3︰8
5、已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10)如图所示,则下列判断错误的是( )
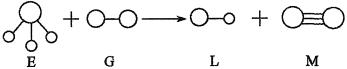
A.G是最活泼的非金属单质
B.L是极性分子
C.E能使紫色石蕊试液变蓝色
D.M化学性质活泼
6、将a L NH3通过灼热的装有铁触媒的硬质玻璃管后,气体体积变为b L(气体体积均在同温同压下测定),该b L气体中NH3的体积分数是( )

7、分子式为HxROy,和Hx+1R′Oy+1的两种酸物质的量浓度相同(两种酸所含氢均可电离成H+),当分别和NaOH溶
液发生中和反应时消耗等物质的量的NaOH,则HxROy和Hx+1R′Oy+1两溶液体积之比为( )
A.x︰(x+1) B.(x+1)︰x
C.1︰1 D.(x+1)︰l
8、下面是实验室制取氨气的装置和选用的试剂,其中错误的是( )

9、当镁与某浓度的硝酸反应时,若参加反应的Mg与HNO3的物质的量之比为2︰5,则硝酸的还原产物可能是( )
A.NO B.NO2
C.N2O D.NH4NO3
10、某金属的硝酸盐强热后分解生成的NO2和O2的物质的量之比为8︰1,在加热过程中,该金属元素的化合价( )
A.降低 B.升高
C.不变 D.无法确定
11、将m g Fe置于稀HNO3中二者恰好完全反应,若硝酸的还原产物中只有NO,则HNO3的用量可能是( )
A.3.5m g B.2.5m g
C.5m g D.
12、有关NH3的下列说法不正确的是( )
A.NH3是4核10电子三角锥形极性分子
B.氨水的浓度越大,则密度越小
C.氨气遇酸都产生白烟
D.氨可用无水CaCl2干燥,在空气中可以燃烧
13、某合作学习小组讨论辨析以下说法:①粗盐和酸雨都是混合物;②沼气和水煤气都是可再生能源;③冰和干冰既是纯净物又是化合物;④不锈钢和目前流通的硬币都是合金;⑤盐酸和食醋既是化合物又是酸;⑥纯碱和熟石灰都是碱;⑦豆浆和雾都是胶体。上述说法正确的是( )
A.①②③④ B.①②⑤⑥
C.③⑤⑥⑦ D.①③④⑦
14、下列装置或操作能达到实验目的的是( )
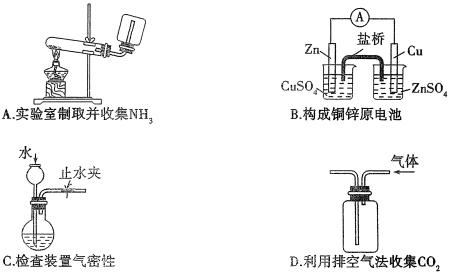
15、下列溶液中有关物质的量浓度关系正确的是( )
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:
c(H+)+c(M+)=c(OH-)+c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:
c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:
c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
D.0.1mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
[提示]
二、综合题
16、A、B、C、D是四种常见的非金属单质,这些单质中B是一种最轻的气体,C是一种无色气体,D是一种黄绿色气体,A是一种蜡状固体。这些单质和甲、乙、丙、X、Y五种化合物之间存在如下关系(如图所示):
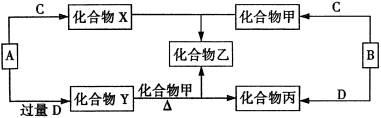
以上所涉及元素均为短周期元素,据此推断:
(1)写出化合物乙的化学式____________________。
(2)上述图示中的化学反应共有__________种基本反应类型,其中共有__________个化合反应。
(3)上述四种单质中存在的同素异形体的元素是__________。(写元素符号)
[答案]
17、将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2的混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的体积为__________L,NO2的体积为__________L。
(2)待产生的气体全部释放后,向溶液中加入V mL a mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为__________mol·L-1。
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水__________g。
[答案]
18、为了检验Pb(NO3)2热分解的产物,有人用如图中的装置进行实验。(图中铁架台、铁夹和加热设备均略去)
实验时在试管中放入研细的Pb(NO3)2晶体;实验结束后,试管中得到黄色粉末(PbO),U形管下部有少量液体X,集气瓶中收集到无色气体Y。
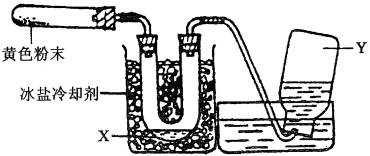
回答下面问题:
(1)在装置中试管和U形管上的橡皮塞最好有锡箔包住,有橡皮管连接的两玻璃管口要相互紧靠,原因是________________________________________。
(2)液体X可能是____________________;气体Y可能是____________________。
(3)导管口不再有气泡冒出时,停止反应,这时在操作上应注意__________,理由是______________________________。
(4)用简单的实验证实(2)中的判断。
①对X的判断;
②对Y的判断(要求:怎样从水槽中取出集气瓶、实验方法、现象、结论)。
[答案]
19、将一定质量的铜粉加入到装有100mL某浓度的稀硝酸溶液中充分反应。
(1)当容器中剩有m1 g的铜粉时,收集到标准状况下448mL的NO气体。
①所得溶液中溶质的化学式是__________。
②原硝酸溶液的物质的量浓度为__________mol·L-1。
(2)向上述固—液混合物中逐滴加入稀硫酸直到刚好不再产生气体为止,该气体遇空气变红棕色。此时容器中有铜粉m2 g。
①此时溶液中溶质的化学式是__________。
②写出加入稀硫酸后所发生反应的离子方程式____________________。
③m1-m2=____________________。
[答案]
20、四川有丰富的天然气资源。以天然气为原料合成尿素的主要步骤如图所示(图中某些转化步骤及生成物未列出):
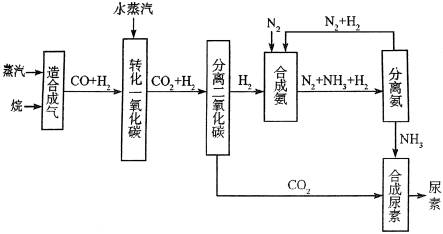
请填写下列空白:
(1)已知0.5mol甲烷与0.5mol水蒸气在t℃、pkPa时,完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量,该反应的热化学方程式是______________________________。
(2)在合成氨的实际生产过程中,常采取的措施之一是将生成的氨从混合气体中及时分离出来,并将分离出氨后的氮气和氢气循环利用,同时补充氮气和氢气。请运用化学反应速率和化学平衡的观点说明采取该措施的理由:______________________________.
(3)当甲烷合成氨气的转化率为75%时,以5.60×107L甲烷为原料能够合成__________L氨气。(假设体积均在标准状况下测定)
(4)已知尿素的结构简式为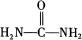 ,请写出两种含有碳氧双键的尿素的同分异构体的结构简式: ,请写出两种含有碳氧双键的尿素的同分异构体的结构简式:
①__________________________________________________;
②__________________________________________________。
[答案]
|