1、将FeCl3溶液滴入沸水可得到红褐色液体,此液体不具有的性质是( )
A.光束通过该液体时形成光亮的“通路”
B.插入电极通直流电后,有一极附近液体颜色加深
C.向该液体中加入硝酸银溶液,无沉淀产生
D.将该液体加热、蒸干、灼烧后,有氧化物生成
2、用某种仪器量取液体体积时,平视读数为a mL,仰视时读数为b mL,俯视时读数为c mL,若b>a>c,则所用的仪器可能为( )
A.量筒 B.容量瓶
C.酸式(碱式)滴定管 D.以上都不对
3、在10mLpH=12的氨水中,加入V mL pH=2的盐酸。则下列说法正确的是( )
A.若V=10,则所得混合溶液的pH小于7
B.若V=10,混合溶液中离子浓度大小关系为:c(Cl-)>c(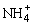 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
C.所得混合溶液中一定存在c(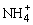 )+c(NH3·H2O)=0.01 mol·L-1
)+c(NH3·H2O)=0.01 mol·L-1
D.所得混合溶液中一定存在c(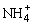 )+c(H+)=c(Cl-)+c(OH-)
)+c(H+)=c(Cl-)+c(OH-)
4、常温下,下列混合溶液中,各离子浓度的关系正确的是( )
A.pH=12的氨水溶液与pH=2的盐酸等体积混合:c (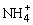 )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
B.浓度均为0.1 mol·L-1的硫酸氢铵溶液与氢氧化钠溶液等体积混合:c(Na+)>c(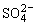 )>c(
)>c(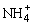 )
)
>c(H+)>c(OH-)
C.浓度均为0.1 mol·L-1的小苏打溶液与氢氧化钠溶液等体积混合:c(Na+)+c(H+)=2c(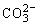 )+c(OH-)
)+c(OH-)
D.浓度均为0.1 mol·L-1的醋酸溶液与氢氧化钠溶液等体积混合:c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
5、A、B、C、D、E为原子序数依次递增的同一短周期元素,x、y为正整数,下列说法中一定正确的是( )
A.若C的最低负价为-3,则5种元素都是非金属元素
B.若A(OH)x为强碱,则B(OH)x+1也为强碱
C.若D的气态氢化物分子式为H2D,则E的最高价氧化物对应的水化物分子式为H2EO4
D.若HxCOy为强酸,则D是活泼非金属元素
6、使相同物质的量浓度的NaCl、MgCl2、AlCl3溶液中的Cl-完全沉淀所用相同浓度的AgNO3溶液体积比为3︰2︰1,则上述三种溶液的体积比是( )
A.9︰3︰1 B.9︰4︰1
C.6︰3︰2 D.3︰2︰1
7、新京报2006年9月16日报道,上海数百人因食用含瘦肉精的猪肉而中毒。“瘦肉精”中文名称叫盐酸克伦特罗,化学名称为:羟甲叔丁肾上腺素,临床用于支气管哮喘治疗,是一种对心脏的毒副作用较大的兴奋剂。“瘦肉精”的分子结构为:
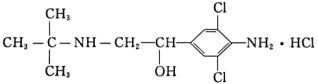
就上述结构简式分析下列说法中不正确的是( )
A.“瘦肉精”分子内至少有12个原子处于同一平面
B.“瘦肉精”分子可发生消去反应和加成反应
C.“瘦肉精”分子不能与NaOH溶液发生反应
D.“瘦肉精”分子不能和FeCl3溶液发生显色反应
8、可逆反应aX(g)+bY(g)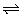 cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)随时间(t)变化的图象如图。则下列说法中正确的是( )
cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)随时间(t)变化的图象如图。则下列说法中正确的是( )
A.若a+b=c,则t0时只能是增大了容器的压强
B.若a+b=c,则t0时只能是加入了催化剂
C.若a+b≠c,则t0时只能是增大了容器的压强
D.若a+b≠c,则t0时只能是加入了催化剂
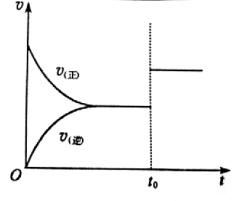
9、按图的装置进行电解实验:A极是铜锌合金,B极为纯铜,电解质溶液中含有足量的铜离子。通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68 g,溶液质量增加0.03 g,则A极合金中Cu、Zn原子个数比为( )
A.4︰1 B.3︰1
C.2︰1 D.任意比
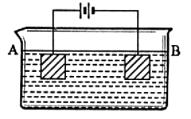
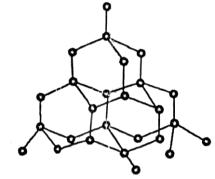
10、化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示。现提供以下化学键的键能:
P—P:198 kJ·mol-1 P—O:360 kJ·mol-1 O=O:498 kJ·mol-1
则反应P4(白磷)+3O2=P4O6的反应热△H为( )
A.-1638 kJ·mol-1 B.+1638 kJ·mol-1
C.-126 kJ·mol-1 D.+126 kJ·mol-1
11、有一种MCFC型燃料电池,该电池所用燃料为H2和空气,电解质为熔融的K2CO3。电池的总反应为:2H2+O2=2H2O,负极反应为H2+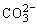 -2e-=H2O+CO2。下列说法中,正确的是( )
-2e-=H2O+CO2。下列说法中,正确的是( )
A.正极反应为4OH--4e-=2H2O+O2↑
B.电池放电时,电池中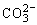 的物质的量将逐渐减少
的物质的量将逐渐减少
C.放电时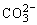 向负极移动
向负极移动
D.电路中的电子经正极、负极、熔融的K2CO3后再回到正极,形成闭合回路
12、用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.100 mL 2.0 mol·L-1的盐酸与醋酸溶液中氢离子个数均为0.2NA
B.含S2、S4和S6等分子的64 g硫蒸气中含有原子总数为2 NA
C.28g晶体硅(结构如图)中含有Si—Si键总数为NA
D.12.5 mL 16 mol·L-1浓硫酸与足量铜反应,转移的电子数目为0.2 NA
13、为检验下列长期露置于空气中化学试剂是否变质,所选检验试剂(括号内化学药品)正确的是( )
A.Na2SO3溶液(BaCl2溶液)
B.FeSO4溶液(KSCN)
C.苯酚晶体(FeCl3溶液)
D.浓H2SO4(锌粒)
14、氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是( )
A.再通入少量氯气, 减小
减小
B.通入少量SO2,溶液漂白性增强
C.加入少量固体NaOH,一定有c(Na+)=c(Cl-)+c(ClO-)
D.加入少量水,水的电离平衡向正反应方向移动
15、下列叙述正确的是( )
A.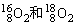 互为同位素,性质相似
互为同位素,性质相似
B.常温下,pH=1的水溶液中Na+、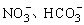 、Fe2+可以大量共存
、Fe2+可以大量共存
C.明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同
D.C(石墨,s)=C(金刚石,s)△H>O,所以石墨比金刚石稳定
16、下列关于元素的叙述正确的是( )
A.金属元素与非金属元素能形成共价化合物
B.只有在原子中,质子数才与核外电子数相等
C.目前使用的元素周期表中,最长的周期含有36种元素
D.非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8
17、(1)三氧化铀(UO3)溶于酸生成铀二氧根盐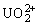 ,例如UO3溶于HNO3反应为:UO3+2HNO3=UO2(NO3)2+H2O。在UO2(NO3)2中U元素呈________价。
,例如UO3溶于HNO3反应为:UO3+2HNO3=UO2(NO3)2+H2O。在UO2(NO3)2中U元素呈________价。
(2)沥青铀矿的主要成份为U3O8,U3O8溶于硫酸的反应为:U3O8+4H2SO4=2UO2SO4+U(SO4)2+4H2O,根据上述反应,模拟Fe3O4可写成FeO·Fe2O3的形式,可将U3O8写成:__________的形式。
(3)由于硝酸是强氧化剂,故U3O8溶于稀HNO3铀元素全部转化为UO2(NO3)2。
①配平U3O8溶于稀HNO3的化学反应方程式:
_______U3O8+_______HNO3=_______UO2(NO3)2+_______NO↑+H2O
②反应中l mol还原剂______(填“得到”或“失去”) _______mol电子。被氧化的元素是______________。
(4)当转移3 mol电子时被氧化元素的质量是_______g。
18、在元素周期表中,相邻近的元素在结构和性质上有许多相邻之处。第二周期的碳、氮、氧、氟都可以形成氢化物,氧元素的氢化物除H2O外,还有H2O2;碳元素的氢化物除CH4外,还有C2H6等;与之相似的氮元素的氢化物除NH3外,还有N2H4等。
(1)碳原子之间可结合成链状结构,氮原子之间也可形成链状结构,假设氮原子间只以N—N键形式连接,并形成氢化物,则该系列氢化物的通式为______________。
(2)该系列中的N2H4是“神六”发射时火箭所用的液态燃料,液态N2O4作氧化剂,生成氮气和气态水,此液态燃料的优点是产生的能量大且无污染。已知4 g N2H4在上述反应放出71 kJ的热量,写出此反应的热化学方程式______________。
(3)该系列物中NH3对农业、化学和国防工业具有重要意义。其合成氨反应是
N2(g)+3H2(g)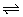 2NH3(g);△H=-92 kJ·mol-1
2NH3(g);△H=-92 kJ·mol-1
①在一定温度下,将1.5 mol N2和6 mol H2通入到一个固定容积的密闭容器中,当反应达到平衡时,容器内气体的压强为起始时的80%,此时反应放出的热量为______________。
②保持温度不变,在相同的容器中,将起始时的物质的量改为a mol N2、b mol H2和c mol NH3,使平衡时各组分的物质的量分数与①中对应相等,则:
a.达到平衡时,①与②放出的热量 _______(填字母代号)。
A.一定相等 B.前者一定,小于后者
C.前者等于或小于后者 D.前者等于或大于后者
b.欲使该反应正向进行,a的取值范围是______________。
19、2007年8月《环球时报》(美)报道,ACV浓缩饮料风靡全美,ACV具有解毒、降脂、减肥和止泻等多种疗效,其中苹果酸M(分子量134)是主要的活性物质,其化学成分及有关实验如下:
①M分子中含C 35.82%(质量分数,下同),含H 4.51%,其余为氧元素;
②各取1×10-3 mol M分别与足量NaHCO3反应放出CO2 44.8 mL(标准状况,下同),与足量金属钠反应放出H2 33.6 mL
③M分子中所有碳原子在同一链线上
回答下列问题:
(1)M的化学式为:_______,分子结构中含有的官能团名称是_______。
(2)已知M有多种同分异构体,试写出其中符合下述要求的结构简式(限写一种)。l mol该有机物与足量金属钠反应生成1 mol H2:__________________。
(3)为制备M,化学工作者从某气态烃与溴蒸气的取代产物分离出一种多溴代烃N,经步反应,最后生成M。
已知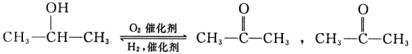 不能被O2氧化,但可与H2加成
不能被O2氧化,但可与H2加成
合成路线为:N→有机物A→有机物B→有机物C→M,其中B能发生银镜反应。
①有机物N的结构简式为____________________。
②A转化为B的化学方程式为____________________。
③有机物C转化为M的反应类型为____________________。
(4)实验证明M分子间可形成具有水果香味的化合物,若该化合物中含有环状结构,其结构简式可能为:____________________。