1、实验室利用氧化还原反应制取的气体是( )
①HCl ②H2S ③O2 ④CO2 ⑤Cl2 ⑥NO
A.①③⑤ B.②⑤⑥
C.③④⑤ D.③⑤⑥
2、下列反应中生成物总能量高于反应物总能量的是( )
A.碳酸钙受热分解 B.乙醇燃烧
C.铝粉与氧化铁粉末反应 D.氧化钙溶于水
3、24 mL浓度为0.05 mol·L-1的Na2SO3溶液,恰好与20 mL浓度为0.02 mol·L-1的K2Cr2O7溶液完全反应,则元素Cr在被还原的产物中的化合价是( )
A.+6 B.+3
C.+2 D.0
4、在反应8P+3KOH+9H2O=3KH2PO4+5PH3中,氧化剂与还原剂的质量比为( )
A.8︰3 B.3︰8
C.3︰5 D.5︰3
5、已知反应:①101 kPa时,2C(s)+O2(g)=2CO(g);△H=-221 kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq)=H2O(l);△H=-57.3 kJ·mol-1
下列结论正确的是( )
A.碳的燃烧热大于110.5 kJ·mol-1
B.①的反应热为221 kJ·mol-1
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ·mol-1
D.稀醋酸与稀NaOH溶液反应生成1 mol H2O,放出57.3 kJ热量
6、某金属单质与一定浓度的硝酸反应,假定只产生单一的还原产物。当参加反应的单质与被还原的硝酸的物质的量之比为2︰1时,还原产物为( )
A.N2O B.NO
C.NO2 D.N2
7、根据下列反应判断有关物质还原性由强到弱的顺序是( )
(1)H2SO3+I2+H2O=2HI+H2SO4
(2)2FeCl3+2HI=2FeCl2+2HCl+I2
(3)3FeCl2+4HNO3=2FeCl3+NO↑+2H2O+Fe(NO3)3
A.H2SO3>I->Fe2+>NO B.I->Fe2+>H2SO3>NO
C.Fe2+>I->H2SO3>NO D.NO>Fe2+>H2SO3>I-
8、ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:
2KClO3+H2C2O4+H2SO4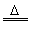 2ClO2↑+K2SO4+2CO2↑+2H2O
2ClO2↑+K2SO4+2CO2↑+2H2O
下列说法正确的是( )
A.KClO3在反应中得到电子
B.ClO2是氧化产物
C.H2C2O4在反应中被氧化
D.1 mol KClO3参加反应有2 mol电子转移
9、向100 mL含等物质的量HBr和H2SO3的溶液里通入0.01 mol Cl2,有一半Br-变为Br2(已知Br2能氧化H2SO3)。原溶液中HBr和H2SO3的浓度都等于( )
A.0.0075 mol·L-1
B.0.0018 mol·L-1
C.0.075 mol·L-1
D.0.08 mol·L-1
10、25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ·mol-1、285.8kJ·mol-1、
890.3kJ·mol-1、2800kJ·mol-1,则下列热化学方程式正确的是( )
A.C(s)+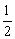 O2(g)=CO(g);△H=393.5kJ·mol-1
O2(g)=CO(g);△H=393.5kJ·mol-1
B.2H2(g)+O2(g)=2H2O(g);△H=+571.6kJ·mol-1
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=-890.3kJ·mol-1
D.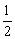 C6H12O6(s)+3O2(g)=CO2(g)+3H2O(l);△H=-1400kJ·mol-1
C6H12O6(s)+3O2(g)=CO2(g)+3H2O(l);△H=-1400kJ·mol-1
11、下列各组热化学方程中,化学反应的△H前者大于后者的是( )
①C(s)+O2(g)=CO2(g);△H1 C(s)+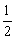 O2(g)=CO(g);△H2
O2(g)=CO(g);△H2
②S(s)+O2(g)=SO2(g);△H3 S(g)+O2(g)=SO2(g);△H4
③H2(g)+ O2(g)=H2O(l);△H5 2H2(g)+O2(g)=2H2O(l);△H6
O2(g)=H2O(l);△H5 2H2(g)+O2(g)=2H2O(l);△H6
④CaCO3(s)=CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)=Ca(OH)2(s);△H8
A.① B.④
C.②③④ D.①②③
12、化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如图所示。现提供以下化学键的键能:

P—P:198 kJ·mol-1 P—O:360 kJ·mol-1 O=O:498 kJ·mol-1
则反应P4(白磷)+3O2=P4O6的反应热△H为( )
A.-1638 kJ·mol-1
B.+1638 kJ·mol-1
C.-126 kJ·mol-1
D.+126 kJ·mol-1
13、在相同条件下,下列三个热化学方程式中△H比较正确的是( )
(1)CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H1
(2)CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H2
(3)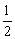 CH4(g)+O2(g)=
CH4(g)+O2(g)=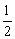 CO2(g)+H2O(g);△H3
CO2(g)+H2O(g);△H3
A.△H1<△H2<△H3 B.△H1>△H2,△H3=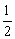 △H1
△H1
C.△H1=△H2=△H3 D.无法比较
14、下列各组对△H的比较正确的是( )
A.2K(s)+H2O(l)=2KOH(aq)+H2(g);△H1
2Na(s)+H2O(l)=2NaOH(aq)+H2(g);△H2,则△H1>△H2
B.Mg(s)+2HCl(aq)=MgCl2(aq)+H2(g);△H1
Ca(s)+2HCl(aq)=MgCl2(aq)+H2(g);△H2,则△H1>△H2
C.H2(g)+Cl2(g)=2HCl(g);△H1
H2(g)+Br2(g)=2HBr(g);△H2,则△H1>△H2
D.2Fe(s)+3Br2(g)=2FeBr3(s);△H1
2Fe(s)+3Cl2(g)=2FeCl3(s);△H2,则△H1>△H2
15、在100 g碳不完全燃烧所得气体中,CO占1/3体积,CO2占2/3体积,且
C(s)+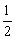 O2(g)=CO(g);△H=-110.35kJ/mol
O2(g)=CO(g);△H=-110.35kJ/mol
CO(g)+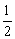 O2(g)=CO2(g);△H=-282.57kJ/mol
O2(g)=CO2(g);△H=-282.57kJ/mol
与这些碳完全燃烧相比,损失的热量是( )
A.392.92 kJ B.2489.44 kJ
C.784.92 kJ D.3274.3 kJ
16、已知:
C(s)+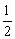 O2(g)=CO(g);△H=-110.5kJ/mol
O2(g)=CO(g);△H=-110.5kJ/mol
C(s)+ O2(g)=CO2(g);△H=-393.51kJ/mol
计算反应C(s)+CO2 (g)=2CO(g)的反应热,△H为( )
A.-283.01 kJ/mol B.+172.51 kJ/mol
C.+283.1 kJ/mol D.+504.00 kJ/mol
18、2 g Cu2S和CuS的混合物在酸性溶液中用400 mL 0.075 mol·L-1 KMnO4溶液处理,发生反应如下:
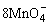 +5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
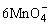 +5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
______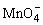 +______Fe2++______H+=______Mn2++______Fe3++______H2O
+______Fe2++______H+=______Mn2++______Fe3++______H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为________mol。
(3)欲配制500 mL 0.1 mol·L-1 Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392 g·mol-1)的质量为________g。
(4)混合物中Cu2S的质量分数为________。
19、据统计,40%的飞机失事时构成机舱内壁和座椅的塑料会着火冒烟导致舱内人员窒息而亡。为此,寻找装修机舱的阻燃聚合物是化学研究的热点之一,最近有人合成了一种叫PHA的高聚物,就是在某聚乙烯树脂中加入等质量由特殊工艺制备的阻燃型Mg(OH)2,树脂可燃性大大降低。该Mg(OH)2的生产工艺如下:
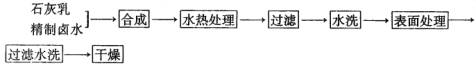
(1)精制卤水中的MgCl2与适量石灰乳反应合成碱式氯化镁[Mg(OH)2-xClx·mH2O],反应的化学方程式为___________。
(2)合成反应后,连续在393 K~523 K下水热处理8 h,发生反应:
Mg(OH)2-xClx·mH2O=(1-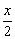 )Mg(OH)2+
)Mg(OH)2+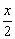 MgCl2+mH2O
MgCl2+mH2O
经过水热处理后需过滤、水洗,其目的是_________。
(3)阻燃型Mg(OH)2具有晶粒大、易分散、与高分子材料相容性好等特点。上述工艺流程中与此有关的步骤是____________。
(4)已知热化学方程式:
Mg(OH)2(s)=MgO(s)+H2O(g);△H1=+81.5 kJ·mol-1
Al(OH)3(s)=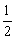 Al2O3(s)+
Al2O3(s)+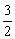 H2O(g);△H2=+87.7 kJ·mol-1
H2O(g);△H2=+87.7 kJ·mol-1
①Mg(OH)2和Al(OH)3起阻燃作用的主要原因是_________。
②等质量Mg(OH)2和Al(OH)3相比,阻燃效果较好的是________。原因是_____________。
(5)常用的阻燃剂主要有三类:A.卤系,如四溴乙烷;B.磷系,如磷酸三苯酯;C.无机类,主要是Mg(OH)2和Al(OH)3。从环保的角度考虑,应用时较理想的阻燃剂是_________(填代号),理由是________________。
20、已知单质铁溶于一定浓度的硝酸溶液中,反应的离子方程式为:
aFe+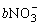 +cH+=dFe2++fFe3++g NO↑+hN2O↑+kH2O(化学计量数a~k均为正整数)。
+cH+=dFe2++fFe3++g NO↑+hN2O↑+kH2O(化学计量数a~k均为正整数)。
回答下列问题:
(1)根据反应中氮、氢、氧三种元素的原子个数守恒,可得c、g、h的关系式(用一个代数式表示。下同) __________________。
(2)根据反应中离子的电荷守恒,可得b、c、d、f的关系式是__________________。
(3)根据反应中电子转移的总数相等,可得d、f、g、h的关系式是__________________。
(4)若a=12,且铁和稀硝酸恰好完全反应,则b的取值范围是_________;c的取值范围是_________。