1、下列反应的离子方程式正确的是( )
A.新制的硫酸亚铁溶液和过氧化氢溶液反应:
Fe2++2H++H2O2=Fe3++2H2O
B.向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至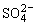 恰好沉淀完全:
恰好沉淀完全:
2Al3++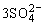 +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
C.向次氯酸钙溶液中通入少量二氧化硫:
Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
D.FeBr2(aq)中通入足量Cl2:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
2、下列家庭小实验中不涉及化学变化的是( )
A.用熟苹果催熟青香蕉
B.用少量食醋除去水壶中的水垢
C.用糯米、酒曲和水制成甜酒酿
D.用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐
3、氯水中存在多种微粒,下列有关粒子的表示方法正确的是( )
A.氯气的电子式:Cl︰Cl
B.次氯酸分子的结构式:H—O—Cl
C.氢氧根离子的电子式: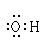
D.水分子的比例模型:
4、常温下,有甲、乙两份体积均为1L,浓度均为0.1mol·L-1的氨水,其pH为11。①甲用蒸馏水稀释100倍后,溶液的pH为a;②乙与等体积、浓度为0.2mol·L-1的HCl混合,在混合溶液中: +c(H+)-c(OH-)=b mol·L-1。A、b正确的答案组合是( )
+c(H+)-c(OH-)=b mol·L-1。A、b正确的答案组合是( )
A.9~11之间;0.1 B.9~11之间;0.2
C.12~13之间;0.2 D.13;0.1
5、甲醇、乙醇、氢气及二甲醚(CH3OCH3,气体)的燃烧热分别为726.6kJ/mol、1366kJ/mol、285.8kJ/mol、1455kJ/mol。有关其说法正确的是( )
A.常温常压下,等体积四种燃料充分燃烧放出热量最多的是二甲醚
B.常温下,46g乙醇与3mol O2所含的能量高于2mol CO2所含的能量
C.甲醇燃烧的热化学方程式:
2CH3OH(g)+3O2(g)→2CO2(g)+4H2O(1);△H=-726.6kJ/mol
D.二甲醚燃烧的热化学方程式:
CH3OCH3(g)+3O2(g) →2CO2(g)+3H2O(g);△H=-1455kJ/mol
6、已知:①1mol H2分子中化学键断裂时需要吸收436kJ的能量 ②1mol Cl2分子中化学键断裂时需要吸收243kJ的能量 ③由H原子和Cl原子形成1mol HCl分子时释放431kJ的能量。下列叙述正确的是( )
A.氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)=2HCl(g)
B.氢气和氯气反应生成2mol氯化氢气体,反应的△H=183kJ/mol
C.氢气和氯气反应生成2mol氯化氢气体,反应的△H=-183kJ/mol
D.氢气和氯气反应生成lmol氯化氢气体,反应的△H =-183kJmol
7、铜的冶炼大致可分为:(1)富集:将硫化物矿进行浮选;(2)焙烧,主要反应为:2CuFeS2+4O2=Cu2S+3SO2+2FeO(炉渣);(3)制粗铜,在1200℃发生的主要反应为:2Cu2S+3O2=2Cu2O+2SO2,2Cu2O+Cu2S=6Cu+SO2↑;(4)电解精炼。下列说法正确的是( )
A.上述过程中的尾气均可直接排入空气
B.由6mol CuFeS2生成6mol Cu,反应共消耗12mol O2
C.反应2Cu2O+Cu2S=6Cu+SO2↑中,氧化剂只有Cu2O
D.电解精炼时,粗铜应与外电源正极相连
8、电导仪测得液态BrF3具有微弱的导电性,若液态BrF3具有类似于水的电离方式:H2O+H2O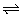 H3O++OH-,则液态BrF3中存在的阴、阳离子是( )
H3O++OH-,则液态BrF3中存在的阴、阳离子是( )
A.Br+和F- B.BrF2+和BrF4-
C.BrF4+和BrF2- D.BrF3+和BrF3-
9、在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序是( )
A.p(Ne)>p(H2)>P(O2) B.p(O2)>P(Ne)>P(H2)
C.p(H2)>p(O2)>p(Ne) D.P(H2)>p(Ne)>p(O2)
10、用NA代表阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,22.4L CHCl2中含有的氯原子数目为3NA
B.7g CnH2n中含有的氢原子数目为NA
C.18g D2O中含有的质子数目为10NA
D.1L 0.5mol/L Na2CO3溶液中含有的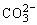 数目为0.5NA
数目为0.5NA
11、室温下,对pH=1、体积相同的盐酸和醋酸两种溶液分别进行下列操作,下列有关分析判断正确的是( )
A.加水稀释100倍后,两溶液的pH仍然相同
B.加入NaOH溶液中和至pH都等于7时,所需NaOH溶液体积相等
C.加入足量的锌粉充分反应,两酸中产生H2的速率始终相等
D.加入足量的大理石充分反应后,醋酸中产生的CO2较多
12、充分燃烧某液态芳香烃X,并收集产生的全部水,恢复至室温时得到水的质量跟原芳香烃X的质量相等,则X的分子式为( )
A.C10H16 B.C11H14
C.C12H18 D.C13H20
13、天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂。关于维生素P的叙述错误的是( )
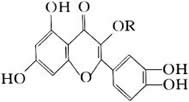
A.可以和溴水反应
B.可用有机溶剂萃取
C.分子中有三个苯环
D.1mol维生素P可以和4mol NaOH反应
14、室温时,下列混合溶液的pH一定小于7的是( )
A.pH=3的盐酸和pH=11的氨水等体积混合
B.pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合
C.pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合
D.pH=3的硫酸和pH=11的氨水等体积混合
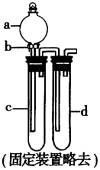 15、某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。
15、某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。
方案 |
反应物 |
甲 |
Cu、浓HNO3 |
乙 |
Cu、稀HNO3 |
丙 |
Cu、O2、稀HNO3 |
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c。其目的是_____________________________________。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2mL浓硝酸。c中反应的化学方程式是____________________。再由a向c中加2mL蒸馏水,c中的实验现象是____________________。
(3)题中表格是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是_________________。理由是____________________。
(4)该小组还用上述装置进行实验证明氧化性KMnO4>Cl2>Br2。操作步骤为__________,实验现象为____________________;但此实验的不足之处是__________。
16、用A+、B-、C2-、D、E、F、G和H分别表示含有18个电子的八种微粒(离子或分子)。请回答:
(1)A元素是__________、B元素是__________、C元素是__________ (用元素符号表示)。
(2)D是由两种元素组成的双原子分子,其分子式是__________。
(3)E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是__________。
(4)F是由两种元素组成的三原子分子,其分子式是__________,电子式是__________。
(5)G分子中含有4个原子,其分子式是____________________。
(6)H分子中含有8个原子,其分子式是____________________。
17、已知硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸。
(1)请写出并配平上述反应的化学方程式:______________________________。
(2)此反应的还原剂是__________,它的氧化产物是____________________。
(3)此反应的离子反应方程式可表示为____________________。
(4)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有____________________。
18、腈基(—CN)在酸性条件下水解可以生成羧基(—COOH)。化合物A的结构简式为: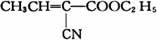 ,将A涂在手术后伤口的表面,在数秒内A迅速固化并起粘结作用以代替通常的缝合。在适宜条件下A可以发生如下一系列转化:
,将A涂在手术后伤口的表面,在数秒内A迅速固化并起粘结作用以代替通常的缝合。在适宜条件下A可以发生如下一系列转化:
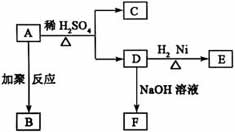
试回答下列问题:
(1)D分子结构中含有的官能团是____________________。
(2)D转化为E的反应属于(选填序号)__________。
①取代反应②加成反应③氧化反应④还原反应
(3)由A生成B的化学反应方程式是:____________________。
(4)写出E属于同一类别有机物的结构简式:______________________________。