一、选择题
1、一小粒金属钠长期置于含CO2的空气中,最后变成的白色粉末是( )
A.Na2O B.Na2O2
C.NaOH D.Na2CO3
2、金属钠在空气中燃烧生成Na2O2和Na2O的混合物,取此燃烧产物7.48g溶于水制成1L溶液,取10mL用0.1mol·L-1的盐酸20mL恰好中和,可知该燃烧产物中Na2O的质量分数是( )
A.16.6% B.20.2%
C.80% D.78.4%
3、欲使每10个水分子中溶有1个Na+,则90mL水中应投入金属钠的质量为( )
A.10.5g B.11.5g
C.21g D.23g
4、实验室保存金属钠的方法是( )
A.保存在棕色瓶中 B.保存在细沙中
C.保存在水中 D.保存在煤油中
5、下列各组中的两物质作用时,反应条件或反应物用量的改变,对产物没有影响的是( )
A.Na2O2和CO2 B.Na与O2
C.NaOH与CO2 D.碳与O2
6、将x mol CO和y mol H2的混合气体充入盛有足量Na2O2的密闭容器中,再通入z mol O2,并用电火花使其充分反应,有关容器内反应的下列叙述不正确的是( )
A.参加反应的Na2O2为(x+y)mol
B.反应前后容器内压强之比(温度不变)为
C.反应后容器中O2为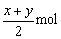
D.反应后生成了x mol Na2CO3和2y mol NaOH
7、等物质的量的N2、O2、CO2混合气体通过Na2O2后,体积变为原体积的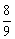 (同温同压),这时混合气体中N2、O2、CO2物质的量之比为( ) (同温同压),这时混合气体中N2、O2、CO2物质的量之比为( )
A.3︰4︰1 B.3︰3︰2
C.6︰7︰3 D.6︰9︰0
8、将3.72 g由金属钠、氧化钠和过氧化钠组成的混合物与足量水反应,在标准状况下得到672mL混合气体。将该混合气体用电火花点燃,恰好完全反应,则原混合物中钠、氧化钠、过氧化钠的物质的量之比为( )
A.3︰2︰1 B.4︰2︰1
C.1︰1︰1 D.2︰1︰1
9、有一些在空气中暴露的KOH固体,经分析测知含水2.8%,含K2CO3 37.3%,取1g该样品投入25mL 2 mol·L-1的盐酸中后,再加1.07mol·L-1的KOH溶液中和剩余的酸,用去30.8mL,蒸干反应后溶液得到的固体是( )
A.3.725g B.0.409g
C.3.316g D.1g
10、将2mol NaHCO3和一定量Na2O2固体混合,在加热条件下让其充分反应,150℃下所得气体仅含2种组分,反应后固体的物质的量n的取值范围是( )
A.n=1 B.1<n<2
C.2≤n<4 D.n≥4
11、有下列物质:酸:盐酸、硝酸、醋酸、稀硫酸;盐(包括正盐和酸式盐):钾盐、钠盐、钡盐。在水溶液中相互混合反应,符合离子方程式: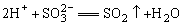 的化学反应方程式共有( ) 的化学反应方程式共有( )
A.10个 B.8个
C.6个 D.4个
12、某二价金属碳酸盐和碳酸氢盐的混合物跟足量盐酸反应,消耗H+和产生CO2的物质的量之比为6︰5,该混合物中碳酸盐和碳酸氢盐的物质的量之比为( )
A.1︰1 B.1︰2
C.1︰3 D.1︰4
13、某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或二种。现将l3.8g样品加入足量水,样品全部溶解,再加入过量的CaCl2溶液,得到9g沉淀。对样品所含杂质的正确的判断是( )
A.肯定有KNO3
B.肯定有KNO3,可能还含有Na2CO3
C.肯定没有Ba(NO3)2,可能有KNO3
D.肯定没有Na2CO3和Ba(NO3)2
14、水蒸气中常含有部分(H2O)2,要确定(H2O)2的存在,可采用的方法是( )
A.1L水蒸气冷凝后与足量金属钠反应,测产生氢气的体积
B.1L水蒸气通过浓硫酸后,测浓硫酸增重的质量
C.该水蒸气冷凝后,测水的pH
D.该水蒸气冷凝后,测氢氧原子比
15、由三种相同体积的气体混合而成的混合气体,依次通过足量NaHCO3溶液、浓H2SO4、灼热的氧化铜和Na2O2后,气体体积共减少了一半(气体体积均在相同条件下测定)。这种混合气体的合理组成是( )
A.NH3、CO、N2 B.HCl、H2、N2
C.SO2、N2、CH4 D.HCl、CO2、CO
[提示]
二、综合题
16、(1)分别写出由氧在一定条件下生成下列物质的化学方程式(必须注明反应条件)。
①O3:________________________________________。
②Na2O2:_____________________________________。
③NaO:______________________________________。
(2)指出氧在下列各物质中的化合价:
O3__________;Na2O2__________;Na2O__________。
(3)KO2能吸收CO2生成K2CO3和O2,故可用作特殊情况下的氧气源,试写出该反应的化学方程式__________________________________________________。
(4)人体内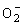 对健康有害,使人过早衰老,但在催化剂SOD存在下可以发生如下反应,请完成该反应的离子方程式: 对健康有害,使人过早衰老,但在催化剂SOD存在下可以发生如下反应,请完成该反应的离子方程式:
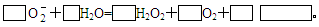
[答案]
17、在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选择适当的化学试剂和实验用品,用图中所示的实验装置进行实验,证明过氧化钠可作供氧剂。
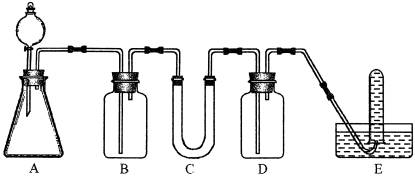
(1)A是制取CO2的装置。写出A中发生反应的化学方程式:________________________。
(2)填写表中空格:
仪器 |
加入试剂 |
加入该试剂的目的 |
B |
饱和NaHCO3溶液 |
|
C |
|
|
D |
|
|
(3)写出过氧化钠与二氧化碳反应的化学方程式:________________________________。
(4)试管F中收集满气体后,下一步实验操作是:__________________________________。
[答案]
18、化学活动课上,三组学生分别用下图所示甲、乙两装置,探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查)。
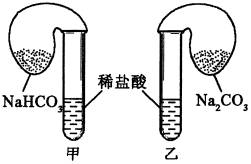
请回答:
(1)各组反应开始时,________装置中的气球体积先变大,该装置中反应的离子方程式是________________________。
(2)当试管中不再有气体生成时,三组实验出现不同现象,填写下表的空格。
| |
试剂用量 |
实验现象(气球体积变化) |
分析原因 |
第①组 |
0.42g NaHCO3
0.53g Na2CO3
3mL 4mol·L-1盐酸 |
甲中气球与乙中气球的体积相等 |
甲、乙盐酸均过量
n(NaHCO3)=n(Na2CO3)
V甲(CO2)=V乙(CO2) |
第②组 |
0.3g NaHCO3
0.3g Na2CO3
3mL 4mol/L盐酸 |
甲中气球比乙中气球的体积大 |
|
第③组 |
0.6g NaHCO3
0.6g Na2CO3
3mL 2mol/L盐酸 |
甲中气球比乙中气球的体积大 |
|
片刻后,乙中气球又缩小,甲中气球的体积基本不变 |
(用离子方程式表示) |
[答案]
19、在一定条件下,使H2和O2混合气体26g充分发生反应。所得产物在适当温度下跟足量的固体Na2O2反应,使固体增重2g。求原混合气体中O2和H2的质量。
[答案]
20、将一定量的CO2气体通入500mL NaOH溶液中,充分反应后,将溶液在低温下蒸发,得到不含结晶水的白色固体A。取三份质量不同的A样品分别与50mL,相同浓度的盐酸反应,得到气体的体积(标准状况)与固体A的质量关系如下表所示。
组别 |
1 |
2 |
3 |
盐酸体积(mL) |
50 |
50 |
50 |
A的质量(g) |
3.80 |
6.20 |
7.20 |
气体体积(mL) |
896 |
1344 |
1344 |
(1)上表中第________组数据表明加入的50mL盐酸反应后有剩余,理由是__________。
(2)试通过计算,推断A的成分及各成分的质量分数。
[答案]
|