一、选择题
1、将等物质的量的镁和铝相混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是( )
A.3 mol·L-1HCl B.4 mol·L-1HNO3
C.8mol·L-1NaOH D.18 mol·L-1H2SO4
2、下列实验不能达到实验目的的是( )
A.用钠、镁分别与冷水反应,证明钠比镁金属性强
B.用MgCl2和AlCl3溶液分别与过量氨水反应,证明镁和铝的金属性强弱
C.用MgCl2和AlCl3溶液分别与过量的NaOH反应,证明镁和铝的金属性强弱
D.用Mg(OH)2和Al(OH)3受热分解的实验,证明镁和铝的金属性强弱
3、将表面已完全钝化的铝条插入下列溶液中,不会发生反应的是( )
A.稀硝酸 B.稀盐酸
C.硝酸铜溶液 D.氢氧化钠溶液
4、将一定量的钠铝合金置于水中,合金全部溶解,得到20 mL pH=14的溶液。然后用l mol·L-1的盐酸滴定至沉淀量最大时,消耗盐酸40 mL。原合金中钠的质量为( )
A.0.92 g B.0.69 g
C.0.46 g D.0.23 g
5、向一种溶液中滴加另一种溶液后,溶液的颜色不发生变化的是( )
A.碳酸氢钠溶液中滴加稀盐酸
B.硫酸铁溶液中滴加硫氰化钾溶液
C.碘水中滴加淀粉碘化钾溶液
D.高锰酸钾酸性溶液中滴加亚硫酸钠溶液
6、含n g HNO3的稀溶液恰好和m g铁完全反应,共有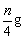 HNO3被还原成NO,则n与m的比值可能是( ) HNO3被还原成NO,则n与m的比值可能是( )
A.1︰l B.2︰1
C.3︰1 D.9︰2
7、将一定量的Fe、Fe2O3、CuO的混合物放入体积为100 mL、浓度为2.2 mol·L-1的H2SO4溶液中,充分反应后,生成气体896 mL(标准状况),得到不溶固体1.28 g。过滤后,滤液中的金属离子只有Fe2+(假设滤液体积仍为100 mL)。向滤液中滴加2 mol·L-1NaOH溶液,直至40 mL时开始出现沉淀。则未滴加NaOH溶液前滤液中FeSO4的物质的量浓度为( )
A.2 mol·L-1 B.1.8 mol·L-1
C.1.9 mol·L-1 D.无法计算
8、向Fe2O3和Fe粉组成的混合物中加入适量的稀硫酸,各物质均恰好完全反应,测得溶液中不含Fe3+,且Fe2+与H2的物质的量之比为4︰1,那么在反应中Fe2O3、Fe、H2SO4之间的物质的量之比为( )
A.1︰1︰l B.1︰2︰4
C.1︰2︰3 D.2︰3︰5
9、将4 g铝、铁合金粉末溶于足量盐酸中,加入过量氢氧化钠溶液,过滤后在滤液中通入足量二氧化碳,再将沉淀滤出,经洗涤、干燥、灼烧后得到固体粉末的质量仍为4 g,原合金中铁的质量分数最接近( )
A.30% B.47%
C.53% D.70%
10、某稀HNO3与6.4 g Cu恰好完全反应,这些酸最多可溶解铁( )
A.0.23 mol B.0.1 mol
C.3.73 g D.5.6 g
11、制印刷电路板时,常用氯化铁溶液作为“腐蚀液”,发生的反应为:2FeCl3+Cu=2FeCl2+CuCl2,向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果中不可能出现的是( )
A.烧杯中有铜无铁 B.烧杯中有铁无铜
C.烧杯中铁、铜都没有 D.烧杯中铁、铜都有
12、铁有可变化合价,将14.4 g草酸亚铁(FeC2O4)在隔绝空气的条件下加热分解,生成一氧化碳、二氧化碳和铁的氧化物,已知最终得到7.2 g铁的氧化物,则该铁的氧化物是( )
A.FeO B.Fe2O3
C.Fe3O4 D.FeO、Fe2O3
13、向一定量的FeO、Fe、Fe3O4的混合物中加入100 mL l mol·L-1盐酸,恰好使混合物完全溶解,放出224 mL(标准状况)气体,在所得溶液中加入KSCN溶液,无红色出现。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是( )
A.11.2 g B.5.6 g
C.2.8 g D.无法计算
14、将物质x逐渐加入y溶液中,生成沉淀物质的量n2与所加x的物质的量n1的关系如图所示,符合图示的情况的是( )

| |
A |
B |
C |
D |
x |
NaOH |
AlCl3 |
HCl |
NaAlO2 |
y |
AlCl3 |
NaOH |
NaAlO2 |
HCl |
15、将a mol钠和a mol铝一同投入到m g足量的水中,所得溶液的密度为d g·mL-1,该溶液中溶质的质量分数为( )

[提示]
二、综合题
16、钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的白色颜料。制取TiO2和Ti的原料是钛铁矿,我国的钛铁矿储量居世界首位。含有Fe2O3的钛铁矿(主要成分为FeTiO3)制取TiO2的流程如图所示。

(1)Ti的原子序数为22,Ti位于元素周期表中第________周期,第________族。
(2)步骤①加Fe的目的是________________;
步骤②冷却的目的是________________。
(3)上述制备TiO2的过程中,可以利用的副产物是________;考虑成本和废物综合利用因素,废液中应加入________处理。
(4)由金红石(TiO2)制取单质Ti,涉及的步骤为: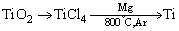 。 。
已知:①C(s)+O2(g)=CO2(g);
△H=-393.5 kJ·mol-1
②2CO(g)+O2(g)=CO2(g);
△H=-566 kJ·mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g);△H=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H=________。
反应TiCl4+2Mg=2MgCl2+Ti在Ar气氛中进行的理由是________________。
[答案]
17、合成氨工业生产中所用的α-Fe催化剂的主要成分是FeO、Fe2O3。
(1)某FeO、Fe2O3混合物中,铁、氧的物质的量之比为4︰5,其中Fe2+与Fe3+物质的量之比为________。
(2)当催化剂中Fe2+与Fe3+的物质的量之比为1︰2时,其催化活性最高,此时铁的氧化物混合物中铁的质量分数为________ (用小数表示,保留2位小数)。
(3)以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:2Fe2O3+C 4FeO+CO2↑。为制得这种活性最高的催化剂,应向480 g Fe2O3粉末中加入炭粉的质量为________g。 4FeO+CO2↑。为制得这种活性最高的催化剂,应向480 g Fe2O3粉末中加入炭粉的质量为________g。
[答案]
18、取一根镁条置于坩埚内点燃,得到氧化镁和氮化镁混合物的总质量为0.470 g。冷却后加入足量水,将反应产物加热蒸干并灼烧,得到的氧化镁质量为0.486 g。
(1)写出氮化镁与水反应生成氢氧化镁和氨的化学方程式。
(2)计算燃烧所得混合物中氮化镁的质量分数。
[答案]
19、向含a mol KAl(SO4)2的溶液中逐滴加入Ba(OH)2溶液。
(1)写出下列反应的离子方程式:
a.滴加Ba(OH)2溶液至KAl(SO4)2溶液中Al3+恰好完全沉淀;
b.滴加Ba(OH)2溶液至KAl(SO4)2溶液中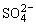 恰好完全沉淀。 恰好完全沉淀。
(2)若已加入的Ba(OH)2溶液中含b mol溶质,试讨论:当a和b的比值为何值时,产生的沉淀的成分及其物质的量各是多少?并将讨论结果填入下表。
[答案]
20、准确称取6 g铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100 mL某浓度的H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol·L-1NaOH溶液,产生沉淀的量(g)与所加入NaOH溶液的体积(mL)的关系如图所示。求:
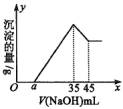
(1)H2SO4溶液的物质的量浓度是多少?
(2)若a=2.3,则铝土矿中各组成成分的质量分数分别是多少?
(3)a的取值范围应在________之间,在这个范围内,a值越大,铝土矿中的________含量越________,________含量越________。
[答案]
|