1、下列离子方程式正确的是( )
A.Cl2与NaOH溶液反应:Cl2+2OH-=Cl-+ClO-+H2O
B.F2与NaOH溶液反应:F2+4OH-=2F-+O2+2H2O
C.AgNO3溶液中加入过量氨水:Ag++2NH3·H2O=Ag(NH4)2++H2O
D.Fe3O4与稀HNO3反应:Fe3O4+8H+=Fe2++2Fe3++4H2O
2、下列有关溶液性质的叙述,正确的是( )
A.室温时饱和的二氧化碳水溶液,冷却到0℃时会放出一些二氧化碳气体
B.20℃,100g水中最多可溶解34.2g KCl,此时KCl饱和溶液的质量分数为34.2%
C.强电解质在水中溶解度一定大于弱电解质
D.相同温度下,把水面上的空气换成相同压力的纯氧,100g水中溶入氧的质量增加
3、下列反应的离子方程式正确的是( )
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体: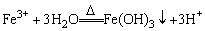
B.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O
C.实验室用浓盐酸与MnO2反应制Cl2: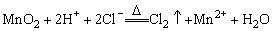
D.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+
4、青霉素试验针用的稀溶液为200国际单位/mL。现有l小瓶20万国际单位青霉索、1.0mL注射器(分刻度为0.1mL)、注射用水和几个干净小瓶。先吸取1.0mL注射用水注入第1小瓶内溶解青霉素,又吸取0.1mL溶液在第2小瓶中用水稀释成1.0mL,再吸取0.1mL在第3小瓶中稀释成1.0mL……在第几小瓶中青霉素浓度为200国际单位/mL( )
A.3 B.4
C.5 D.6
5、下列离子方程式书写正确的是( )
A.碳酸氢钙溶液中加入等物质的量的氢氧化钠溶液
Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
B.碳酸氢钠溶液中加入等物质的量的乙酸
CO32-+2CH3COOH→CO2↑+H2O+2CH3COO-
C.Ca(ClO)2溶液中通入少量的二氧化碳气体
Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
D.用碳棒作电极电解氯化钠饱和溶液
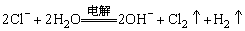
6、下列各组中的离子能在pH=1的无色溶液中大量共存的是( )

7、下列反应的离子方程式中正确的是( )
A.硫酸氢钠溶液中加过量Ba(OH)2溶液:
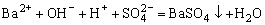
B.含0.1mol FeI2的溶液中滴加含0.05mol Cl2的氯水:
2Fe2++4I-+3Cl2=2Fe3++6Cl-+2I2
C.氯化铝溶液中滴加过量氨水:
Al3++3NH3·H2O=Al(OH)3↓+3NH4+
D.小苏打与少量Ca(OH)2溶液混合:
Ca2++OH-+HCO3-=CaCO3↓+H2O
8、下列反应的离子方程式正确的是( )
A.过量的NaHSO4与Ba(OH)2溶液反应:
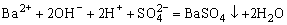
B.NH4HCO3溶液与过量NaOH溶液反应:

C.苯酚钠溶液中通入少量CO2:
C6H5O-+CO2+H2O→C6H5OH+HCO3-
D.FeBr2溶液中通入过量Cl2:
2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
9、联合制碱法中关键的一步是把NH4Cl从几乎饱和的NaHCO3溶液中分离出来,为此根据NaCl和NH4Cl溶解度的差异,向混合溶液中通入某种气体,同时加入磨细的食盐,可析出不夹带NaHCO3的NH4Cl。NaCl和NH4Cl共同存在时的溶解度曲线如图所示,以下操作正确的是( )
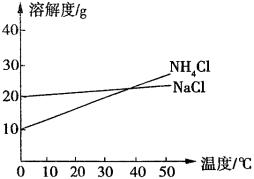
| |
通入气体 |
温度控制 |
A |
CO2 |
30~40℃ |
B |
CO2 |
0~10℃ |
C |
NH3 |
30~40℃ |
D |
NH3 |
0~10℃ |
10、下表为四种溶液的溶质质量分数和物质的量浓度的数值
溶质 |
KOH |
HNO3 |
CH3COOH |
HCl |
溶质质量分数w(%) |
56 |
63 |
60 |
36.5 |
物质的量浓度c(mol/L) |
14.3 |
13.8 |
10.6 |
11.8 |
根据表中数据判断上述四种溶液中的密度最小的是( )
A.HCl B.HNO3
C.CH3COOH D.NaOH
11、xR2++yH++O2=mR3++nH2O的离子方程式,对m和R3+判断正确的是( )
A.m=4,R3+是氧化产物 B.m=y,R3+是氧化产物
C.m=2,R3+是还原产物 D.m=y/2,R3+是还原产物
12、下列反应的离子方程式书写正确的是( )
A.向氢氧化钠溶液中通入少量CO2
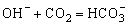
B.用氨水吸收少量SO2
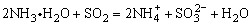
C.硝酸铝溶液中加入过量氨水
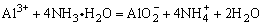
D.向Fe2(SO4)3的酸性溶液中通入足量H2S
Fe3++H2S=Fe2++S↓+2H+
13、已知pH=1的某溶液中存在较多的Ba2+、NO3-,则该溶液中还可能大量存在的离子组是( )

14、某无色溶液中滴入酚酞试液显红色,该溶液中可以大量共存的离子组是( )

15、下列离子方程式或电极反应式正确的是( )
A.用氢氧化铝胶囊治疗胃酸过多:OH-+H+=H2O
B.日常生活中使用漂白粉:CO2+H2O+Ca2++2ClO-=CaCO3↓+2HClO
C.电解法精炼粗铜(含金、银、锌等杂质)的阴极电极反应式:Cu-2e-=Cu2+
D.用Na2S溶液吸收足量的SO2:S2-+2SO2+2H2O=2HSO3-+H2S↑
16、下列A~D四组实验,每组有两个反应,其中两个反应不能用同一个离子方程式表示的是( )
| |
(Ⅰ) |
(Ⅱ) |
A |
少量Ba(HCO3)2滴入到Ba(OH)2溶液中 |
少量Ba(OH)2滴入到足量Ba(HCO3)2溶液中 |
B |
少量浓氨水滴入到Al2(SO4)3溶液中 |
少量Al2(SO4)3溶液滴入到浓氨水中 |
C |
0.1mol Cl2通入到含有0.2mol FeBr2的溶液中 |
0.3mol Cl2通入到含有0.2mol FeBr2的溶液中 |
D |
过量BaCl2溶液与少量Na2SO4溶液相混合 |
少量Ba(NO3)2溶液与过量MgSO4溶液相混合 |
17、经测定某溶液中只含有Na+、CH3COO-、H+、OH-四种离子,且浓度大小顺序为c(CH3COO-)>c(Na+)>c(H+)>c(OH-),其可能的情形是( )
A.该溶液是CH3COONa和CH3COOH的混合溶液
B.该溶液是CH3COONa溶液
C.该溶液是CH3COONa和NaOH的混合溶液
D.向该溶液中加入适量NaOH,可使溶液中离子浓度大小顺序改变为:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
20、某溶液中含有Ba2+、Cu2+、Ag+、Mg2+等四种金属阳离子,现欲将这四种阳离子逐一沉淀下来。某学生设计了如下四种方案。所选试剂及顺序如下:
甲方案:Na2SO4溶液、稀盐酸、H2S、NaOH溶液
乙方案:稀盐酸、Na2SO4溶液、H2S、NaOH溶液
丙方案:NaCl溶液、Na2SO4溶液、NaOH溶液、Na2S溶液
丁方案:Na2S溶液、Na2SO4溶液、NaCl溶液、NaOH溶液
试回答:
(1)你认为可行的方案是__________方案,反应的离子方程式有:__________________。
(2)方案__________不可行的原因是:________________________________________。
方案__________不可行的原因是:________________________________________。
方案__________不可行的原因是:________________________________________。