一、选择题
1、0.1mol某元素的单质直接与氯气反应后,质量增加7.1g,这种元素是( )
A.Na B.Mg
C.Fe D.Cu
2、现有甲、乙、丙三瓶等体积的新制氯水,浓度均为0.1mol·L-1。如果在甲瓶中加入0.001mol NaHCO3固体,在乙瓶中加入0.001mol NaHSO3固体,丙瓶不加任何物质,片刻后,甲、乙、丙三瓶溶液中HClO的物质的量的浓度大小关系是(溶液体积变化忽略不计)( )
A.甲=乙>丙 B.甲>丙>乙
C.丙>甲=乙 D.乙>丙>甲
3、下列表述正确的是( )
①人造刚玉熔点很高,可用作高级耐火材料,主要成分是二氧化硅
②化学家采用玛瑙研钵摩擦固体反应物进行无溶剂合成,玛瑙的主要成分是硅酸盐
③提前建成的三峡大坝使用了大量水泥,水泥是硅酸盐材料
④夏天到了,游客佩戴由添加氧化亚铜的二氧化硅玻璃制作的变色眼镜来保护眼睛
⑤太阳能电池可采用硅材料制作,其应用有利于环保、节能
A.①②③ B.②④
C.③④⑤ D.③⑤
4、某无色混合气体可能含有CO2、CO、H2O(水蒸气)、H2中的一种或几种,依次进行如下处理(假定每次处理均反应完全):①通过碱石灰时,气体体积变小;②通过赤热的氧化铜时,固体变为红色;③通过白色硫酸铜粉末时,粉末变为蓝色;④通过澄清石灰水时,溶液变浑浊。由此可以确定原混合气体中( )
A.一定含有CO2、H2O,可能含有H2、CO中的一种
B.一定含有H2O、CO,可能含有CO2、H2O中的一种
C.一定含有CO、CO2,可能含有H2O、H2中的一种
D.一定含有CO、H2,可能含有H2O、CO2中的一种
5、下列试剂可用带胶塞的无色玻璃瓶保存的是( )
A.液溴 B.氢氟酸
C.硝酸银溶液 D.碳酸钠溶液
6、已知石棉的主要成分是硅酸盐矿物,某种石棉的化学式可表示为Ca2MgxSiyO22(OH)2,则x、y的值分别为( )
A.8、3 B.3、8
C.5、5 D.5、8
7、甲、乙、丙三种溶液各含有一种X-(X-为Cl-、 Br-或I-)离子,向甲中加淀粉溶液和新制的氯水变为橙色,将此溶液倒入丙,颜色无明显变化。由甲、乙、丙依次含有( )
A.Br-、Cl-、I- B.Br-、I-、Cl-
C.I-、Br-、Cl- D.Cl-、I-、Br-
8、有一种碘和氧的化合物可以称为碘酸碘,其中碘元素呈+3、+5两种价态,则这种化合物的化学式是( )
A.I2O4 B.I2O5
C.I4O7 D.I4O9
9、把含有某一种氯化物杂质的氯化镁粉末95mg溶于水后,与足量的AgNO3溶液反应,生成AgCl沉淀300mg,则该氯化镁中杂质可能是( )
A.氯化钠 B.氯化铝
C.氯化钾 D.氯化钙
10、将由KCl和KBr组成的混合物2.0g溶于水配成溶液,在该混合液中先加入足量的AgNO3溶液再加稀HNO3,生成沉淀的质量可能是( )
A.3.66g B.3.96g
C.3.36g D.3.06g
11、纯净的碳酸氢钙试样在高温下分解,当剩余的固体质量为原试样质量的一半时,碳酸氢钙的分解率是( )
A.50% B.75%
C.92.7% D.100%
12、在常温常压下呈气态的化合物,降温使其固化得到的晶体属于( )
A.分子晶体 B.原子晶体
C.离子晶体 D.何种晶体无法判断
13、某不纯的固体烧碱,经分析其中含有3.76%的Na2CO3、90.5%的NaOH、5.74%的水,将其取样m g与80mL 1.00mol·L-1的盐酸反应,过量的盐酸用1.50mol·L-1的NaOH溶液恰好中和,则蒸发中和后的溶液可以得到的固体质量为( )
A.2.34g B.4.68g
C.5.80g D.5.85g
14、在10mL 0.01mol·L-1的纯碱溶液中,不断搅拌并逐滴加入1.2mL 0.05mol·L-1盐酸,完全反应后在标准状况下生成二氧化碳的体积为( )
A.1.344mL B.2.240mL
C.0.672mL D.0mL
[提示]
二、综合题
15、一定量的氯气与a g磷恰好完全反应,全部生成三氯化磷,等质量的氯气和b g磷恰好完全反应,全部生成五氯化磷,则a︰b=__________。
[答案]
16、提取氯化钠、溴、镁等化学物质的富碘卤水中,采用下图所示的工艺流程生产单质碘:
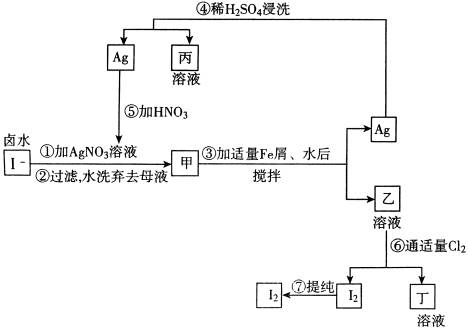
试回答:
(1)乙、丁中溶质的化学式:乙__________;丁__________。
(2)第④步操作中用稀H2SO4浸洗的目的是______________________(填写字母编号)。
a.除去未反应的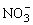 b.除去未反应的I- b.除去未反应的I-
c.除去未反应的Fe d.除去未反应物质
(3)第⑦步操作可供提纯I2的两种方法是__________和__________(不要求写具体步骤)。
(4)实验室检验I2的方法是__________________________________________________。
(5)甲物质见光易变黑,其反应的化学方程式是________________________________。
(6)反应⑤中所加硝酸应选浓HNO3,还是稀HNO3?____________________,原因是:__________________________________________________。
[答案]
17、实验室可用氯气与金属铁反应制备无水三氯化铁,该化合物呈棕红色、易潮解,100 ℃左右时升华。下图是两个学生设计的实验装置,左边的反应装置相同,而右边的产品收集装置不同,分别如(Ⅰ)和(Ⅱ)所示。试回答:
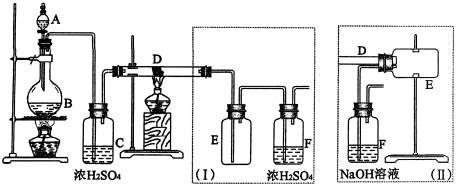
(1)B中反应的化学方程式为________________________________________。
(2)D中的反应开始前,需排除装置中的空气,应采取的方法是____________________。
(3)D中反应的化学方程式为__________________________________________________。
(4)装置(Ⅰ)的主要缺点是____________________________________________________。
(5)装置(Ⅱ)的主要缺点是____________________。如果选用此装置来完成实验,则必须采取的改进措施是__________________________________________________。
[答案]
18、某石灰厂利用本地资源石灰石(所含杂质高温不分解,也不与酸反应),在石灰窑内高温煅烧生产生石灰。取煅烧后的样品5.92g,与25.0mL盐酸恰好完全反应,放出二氧化碳44.8mL(标准状况),滤出残渣0.120g。请计算:
(1)石灰石中碳酸钙的分解率。
(2)所用盐酸的物质的量浓度。
[答案]
19、某烧瓶中盛有50mL浓度为12mol·L-1的浓盐酸,向此烧瓶中加入a g(a<13)MnO2共热,反应停止后,将烧瓶内的液体冷却并蒸干,结果得到b g固体,试求b g固体中氯元素的质量可能是多少?
[答案]
20、实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl:用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和KMnO4;滤去MnO2沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4。请回答:
(1)软锰矿制备K2MnO4的化学方程式是______________________________________;
(2)K2MnO4制备KMnO4的离子方程式是______________________________________;
(3)若用2.5g软锰矿(含MnO2 80%)进行上述实验,计算KMnO4的理论产量:
______________________________________________________________________
(4)KMnO4能与热的经硫酸酸化的Na2C2O4反应生成Mn2+和CO2该反应的化学方程式是 ____________________________________________________________;
(5)上述制得的KMnO4产品0.165g,恰好与0.335g纯Na2C2O4反应完全,计算该KMnO4的纯度。
[答案] |