一、选择题
1、微型钮扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:
Zn+2OH--2e-=ZnO+H2O
Ag2O+H2O+2e-=2Ag+2OH-
根据上述反应式,判断下列叙述中正确的是( )
A.在使用过程中,电池负极区溶液的pH减小
B.使用过程中,电子由Ag2O极经外电路流向Zn极
C.Zn是负极,Ag2O是正极
D.Zn电极发生还原反应,Ag2O电极发生氧化反应
2、A、B、C、D四种金属,将A、B用导线连接后浸在稀硫酸中,金属A表面放出氢气而B逐渐溶解。当电解含有A、C两种金属的可溶性盐溶液时,阴极上首先析出C。把D放入B的硝酸盐溶液中,则D的表面上有B析出。这4种金属的还原性由强到弱的顺序是( )
A.A>B>C>D B.D>C>B>A
C.D>B>A>C D.D>B>C>A
3、我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为:4Al+3O2+6H2O=4Al(OH)3,下列说法不正确的是( )
A.正极反应式为:O2+2H2O+4e-=4OH-
B.电池工作时,电流由铝电极沿导线流向铂电极
C.以网状的铂为正极,可增大与氧气的接触面积
D.该电池通常只需更换铝板就可继续使用
4、为了使埋在地下的钢管不易生锈,设计了如下几种方案:将钢管①用导线跟铅板相连;②用导线跟锌板相连;③用导线跟碳棒相连;④与直流电源负极相连;⑤与直流电源的正极相连。其中正确的是( )
A.②④ B.①④
C.②③ D.①⑤
5、用石墨电极电解足量的下列溶液一段时间后,再加入一定量的另外一种物质(方括号中),溶液能恢复与原来溶液一样的是( )
A.CuCl2[CuCl2] B.NaOH[NaOH]
C.NaCl[HCl] D.CuSO4[Cu(OH)2]
6、Ni-Cd原电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性:Ni—Cd,原电池放电时电极反应式为:
负极反应:Cd-2e-+2OH-= Cd (OH)2
正极反应:2NiO(OH)+2e-+2H2O=2Ni(OH)2+2OH-
下列说法正确的是( )
A.Nj—Cd原电池充电时电池反应为:
Cd+2NiO(OH)+2H2O=Cd(OH)2+2Ni(OH)2
B.Nj—Cd原电池放电时电池内部Cd2+向负极运动
C.Ni—Cd原电池充电时阴极反应为:Cd(OH)2-2e-=Cd+2OH-
D.电池反应中锂、镍、银、铅各失去1 mol电子金属镍所消耗的质量最小
7、某同学按图所示的装置进行电解实验。下列说法正确的是( )
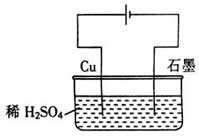
A.电解过程中,铜电极上有H2产生
B.电解初期,主反应方程式为:Cu+H2SO4 CuSO4+H2↑ CuSO4+H2↑
C.电解一定时间后,右墨电极上有铜析出
D.整个电解过程中,H+的浓度不断增大
8、科学家近年来研制出一种新型细菌燃料电池。利用绝菌将有机酸转化成氢气,氢气进入以磷酸为电解质的燃料电池发电。电池负极反应为( )
A.H2+2OH-=2H2O+2e-
B.O2+4H++4e-=2H2O
C.H2=2H++2e-
D.O2+2H2O+4e-=4OH-
9、天津是我国研发和生产锂离子电池的重要基地。锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示,电池反应为LiCoO2+C6 CoO2+LiC6,下列说法正确的是( ) CoO2+LiC6,下列说法正确的是( )
A.充电时,电池的负极反应为LiC6-e-=Li++C6
B.放电时,电池的正极反应为CoO2+Li++e-=LiCoO2
C.羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质
D.锂离子电池的比能量(单位质量释放的能量)低
10、以惰性电极电解CuSO4溶液。若阳极上产生气体的物质的量为0.0100mol,则阴极上析出Cu的质量为( )
A.0.64g B.1.28g
C.2.56g D.5.12g
11、下列描述中,不符合生产实际的是( )
A.电解熔融的氧化铝制取金属铝,用铁作阳极
B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D.在镀件上电镀锌,用锌作阳极
12、用石墨电极电解CuSO4溶液一段时间后,向电解后剩余溶液中加入1molCu(OH)2,能使溶液恢复到电解前的组成与浓度,则转移电子的物质的量为( )
A.1mol B.2mol
C.3mol D.4mol
13、图为氢燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( )
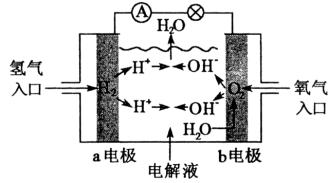
A.a电极是负极
B.b电极的电极反应为:4OH--4e-=2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
14、用两支惰性电极插入CuSO4溶液中,通电电解,当有l×10-3mol OH-放电时,溶液颜色变浅,则下列叙述正确的是( )
A.阳极上析出5.6 mL O2(标准状况)
B.阴极上析出64 mg Cu
C.阴极上析出11.2 mL H2(标准状况)
D.阳极和阴极质量都无变化
15、用两支惰性电极插入500 mL AgNO3溶液中,通电电解,当电解液的pH值从6.0变为3.0时(设阴极没有H2放出,且电解液体积不变),电极上应析出银的质量是( )
A.27 mg B.54 mg
C.108 mg D.216 mg
[提示]
二、综合题
16、电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
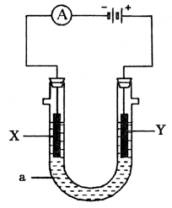
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式是___________。在X极附近观察到的现象是___________。
②Y电极上的电极反应式是___________,检验该电极反应产物的方法是___________。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是___________,电极反应式是___________。
②Y电极的材料是___________,电极反应式是___________。
(说明:杂质发生的电极反应不必写出)
[答案]
17、二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
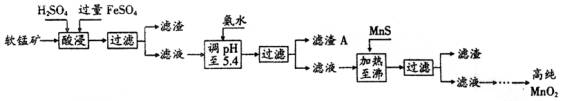
某软锰矿的主要成分为MnO2,还含Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
CuS |
ZnS |
MnS |
FeS |
pH |
5.2 |
3.2 |
9.7 |
10.4 |
6.7 |
8.0 |
≥-0.42 |
≥2.5 |
≥7 |
≥7 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为__________________。
(2)滤渣A的主要成分为_________。
(3)加入MnS的目的是除去_________杂质。
(4)碱性锌锰干电池中,MnO2参与的电极反应方程式为__________________。
(5)从废旧碱性锌锰干电池中可以回收利用的物质有_________ (写出两种)。
[答案]
18、某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
实验步骤 |
实验现象 |
将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中。 |
产生气泡,析出疏松的红色固体,溶液逐渐变为无色。 |
反应结束后分离出溶液备用。 |
|
红色固体用蒸馏水洗涤后,置于潮湿空气中。 |
一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3]。 |
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应______________________________________________________
化合反应______________________________________________________
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可观察到的现象是__________________。
解释此现象的离子方程式是__________________、__________________。
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来冶炼金属锰。
①用铝与软锰矿冶炼锰的原理是(用化学方程式表示) __________________。
②MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是__________________。
[答案]
19、铝和氢氧化钾都是重要的工业产品。请回答:
(1)工业冶炼铝的化学方程式是__________________。
(2)铝与氢氧化钾溶液反应的离子方程式是__________________。
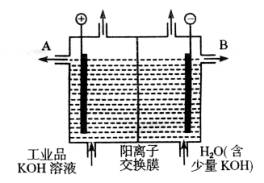
(3)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
①该电解槽的阳极反应式是__________________。
②通电开始后,阴极附近溶液pH会增大,请简述原因:__________________。
③除去杂质后的氢氧化钾溶液从液体出口___________(填写“A”或“B”)导出。
[答案]
20、利用太阳光分解水制取氢是未来解决能源危机的理想方法之一。某研究小组设计了如图所示的循环系统实现光分解水制氢。反应过程中所需的电能由太阳能光电池提供,反应体系中I2和Fe2+等可循环使用。

(1)写出电解池A、电解池B和光催化反应池中反应的离子方程式。
(2)若电解池A中生成3.36 L H2(标准状况),试计算电解池B中生成Fe2+的物质的量。
(3)若循环系统处于稳定工作状态时,电解池A中流入和流出的HI浓度分别为a mol·L-1和b mol·L-1,光催化反应生成Fe3+的速率为c mol·min-1,循环系统中溶液的流量为Q(流量为单位时间内流过的溶液体积)。试用含所给字母的代数式表示溶液的流量Q。
[答案] |