[复习要点阐述]
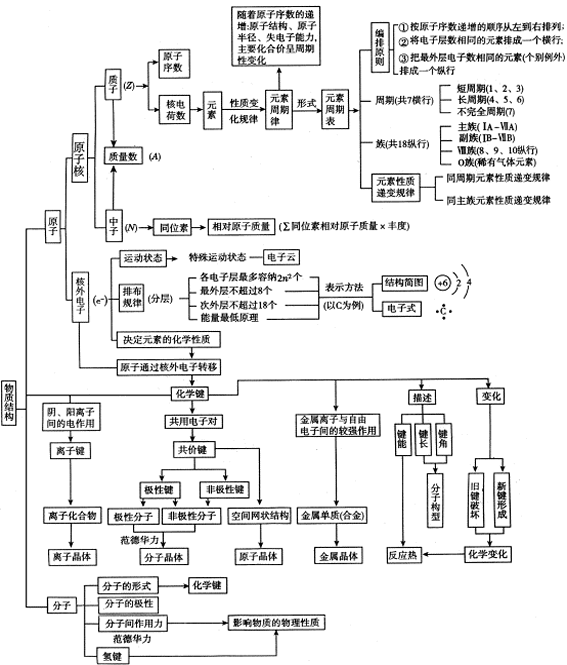
[要点复习的策略及技巧]
1、质子、中子的质量
已知1个碳-12原子质量为:1.9927×10-26kg
1个碳-12原子的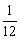 质量为:1.6606×10-27kg
质量为:1.6606×10-27kg
质子质量为1.6726×10-27kg,中子质量为1.6784×10-27kg。据此可求出:
1个质子的相对质量为:
1个中子的相对质量为: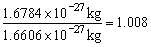
质量数:忽略电子质量,将原子核内所有中子和质子的质量取近似整数值加起来所得的数值。用符号表示为A=Z+N。
2、构成原子或离子微粒间的数量关系
(1)质子数=核电荷数=核外电子数=原子序数。
(2)离子电荷=质子数-核外电子数。
(3)阳离子质子数(Z)=阳离子的核外电子数+阳离子的电荷数。
(4)阴离子质子数(Z)=阴离子的核外电子数-阴离子的电荷数。
(5)质量数近似等于该同位素相对原子质量。
3、原子核外电子的排布
(1)在含有多个电子的原子里,由于电子的能量不同,它们运动的区域也不同。根据这种差别,可以把核外电子运动的不同区域分成不同的电子层。电子层的表示方法如下表:
电子层数(n) |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
符号 |
K |
L |
M |
N |
O |
P |
Q |
能量大小 |
K<L<M<N<O<P<Q |
(2)核外电子的分层运动,又叫核外电子的分层排布,其主要规律是:
①核外电子总是尽先排布在能量最低的电子层里,然后由里向外,依次排布在能量逐渐升高的电子层里(能量最低原理)。
②原子核外各电子层最多容纳2n2个电子。
③原子最外层电子数目不超过8个(K层为最外层时不能超过2个电子)。
④次外层电子数目不能超过18个(K层为次外层时不能超过2个),倒数第3层电子数目不能超过32个。
(3)原子结构的表示方法——原子结构示意图或离子结构示意图。
原子中:核电荷数=核外电子数,原子结构可用原子结构示意图表示。
如: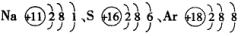 。
。
阳离子:核电荷数>核外电子数,其结构可用离子结构示意图表示。如
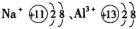
阴离子:核电荷数<核外电子数,其结构可用离子结构示意图表示。如

4、元素与同位素
(1)元素:具有相同核电荷数(即质子数)的同一类原子的总称。
(2)同位素:具有相同质子数而有不同中子数的同一元素的原子互称为同位素。
注意:①同一元素的各同位素原子质量数不同,核外电子数相同,化学性质几乎完全相同。
②不同同位素的原子构成的单质其化学性质几乎相同。
③不同同位素构成的化合物是不同的化合物,H2O、D2O、T2O的物理性质不同,化学性质几乎相同。
5、元素相对原子质量的计算方法
元素(精确)的相对原子质量是根据各种核素的相对原子质量和它们在原子总数中所占的组成分数计算的平均值。
其计算公式为:
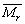 =A·a%+B·b%+C·c%+……
=A·a%+B·b%+C·c%+……
其中A、B、C分别为各同位素的相对原子质量;a%、b%、c%分别为自然界中各同位素所占的原子的含量或原子个数的组成分数; 是元素(精确)的相对原子质量。
是元素(精确)的相对原子质量。
例1、文献资料上记载的相对原子质量数据摘录如下:
35Cl |
34.969 |
75.77% |
35Cl |
35 |
75.77% |
37Cl |
36.966 |
24.23% |
37Cl |
37 |
24.23% |
平均 |
35.453 |
平均 |
35.485 |
试回答下列问题:
(1)34.969是表示________________________________;
(2)35.453是表示________________________________;
(3)35是表示________________________________;
(4)35.485是表示________________________________;
(5)24.23%是表示________________________________;
答案:
(1)34.969是表示同位素(35Cl)的相对原子质量
(2)35.453是表示氯元素的平均相对原子质量,其计算公式为M=34.969×0.7577+36.966×0.2423=35.453
(3)35是表示氯原子(35Cl)的质量数
(4)35.485是表示氯元素的近似相对原子质量
(5)24.23%是表示同位素(37Cl)所占的原子个数百分比(丰度)
6、元素周期律
(1)定义:元素的性质随原子序数的递增而呈现周期性变化的规律叫元素周期律。
(2)内容:
①原子核外电子排布的周期性变化。
最外层电子数:从1→8的周期性变化。
②原子半径的周期性变化。
同周期元素,随原子序数的递增,原子半径从碱金属到卤素逐渐减小的周期性变化。
③元素主要化合价的周期性变化。
正价:+1→+7负价:-4→-1
(3)实质:元素性质随原子序数递增呈现出周期性变化,其本质原因是元素的原子核外电子排布呈现周期性变化的必然结果。
7、元素周期表
(1)元素周期表的编排原则:①按原子序数递增的顺序从左到右排列;②将电子层数相同的元素排成一个横行;③把最外层电子数相同的元素(个别例外)按电子层数递增的顺序从上到下排成纵行。
(2)周期表的结构(7个周期、16个族):

(3)元素周期表的应用
①预测元素的性质:常见的题目是给出一种不常见的主族元素(如砹、碲、铋、铅、铟、镭、铯等),或尚未发现的主族元素,推测该元素及其单质或化合物所具有的性质,解答的关键是根据该元素所在族的其他元素的性质,找出递变规律,加以推测判断。
②启发人们在一定区域内寻找新物质(农药、半导体、催化剂等)。
8、元素周期表中同周期,同主族元素性质的递变规律
项目 |
同周期(从左到右) |
同主族(从上到下) |
最外层电子数(价电子) |
由1逐渐增加到7 |
相同 |
主要化合价 |
最高正价由+1→+7
负价由-4→-l |
最高正价相同 |
原子半径 |
逐渐减小(稀有气体除外) |
逐渐增大 |
金属性与非金属性 |
金属性减弱,非金属性增强 |
金属性增强。非金属性减弱 |
单质的氧化性、还原性 |
还原性减弱,氧化性增强 |
氧化性减弱,还原性增强 |
最高价氧化物对应水化物的酸碱性 |
碱性减弱,酸性增强 |
酸性减弱,碱性增强 |
非金属气态氢化物 |
生成由难到易,稳定性由弱到强 |
生成由易到难,稳定性由强到弱 |
原子得、失电子能力 |
失电子由强→弱,得电子由弱→强 |
得电子由强→弱,失电子由弱→强 |
9、原子结构与元素周期表关系的规律
(1)电子层数=周期数(电子层数决定周期数)。
(2)最外层电子数=主族族序数=最高正价数=主族元素价电子数。
(3)核内质子数=原子序数。
(4)负价绝对值=8-主族族序数(限ⅣA~ⅦA)。
(5)原子半径越大,失电子越易,还原性越强,金属性越强,形成的最高价氧化物的相应水化物碱性越强,其离子的氧化性越弱。
(6)原子半径越小,得电子越易,氧化性越强,非金属性越强,形成的气态氢化物越稳定,形成最高价氧化物的相应水化物酸性越强,其离子的还原性越弱。
10、元素的金属性和非金属性的判断

11、原子半径的变化规律
(1)原子半径的大小主要是由核外电子层数和原子核对核外电子的作用两方面因素决定。一般来说,电子层数越多多的原子,其半径越大;反之,电子层数越少的原子半径越小。当电子层数相同时,随着核电荷数增加,原子半径逐渐减小。
(2)同主族元素的原子和离子半径,从上至下,随着核电荷数的递增,原子半径和离子半径依次增大。
(3)阳离子半径小于相应的原子半径,阴离子半径大于相应的原子半径。
(4)具有相同电子层结构的阴阳离子,随着核电荷数逐渐增加,离子半径逐渐减小。
(5)随着原子序数的递增,元素(除稀有气体外)的原子半径总是重复着由大到小的周期性变化规律。
12、“位——构——性”之间的关系
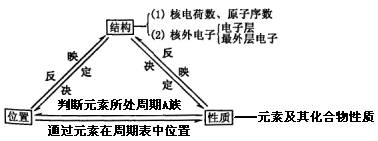
例2、下列各种事实跟原子结构的哪一部分有关?
(1)元素在周期表中的排列顺序;
(2)相对原子质量的大小;
(3)元素具有同位素;
(4)元素的化学性质;
(5)元素的化合价;
(6)元素在周期表里处于哪个周期;
(7)主族元素在周期表里处于哪个族。
解析:
原子结构是指:
答案:
(1)质子数;(2)质子数和中子数;(3)原子具有相同的质子数、不同的中子数;(4)最外层电子数;(5)最外层的电子数(有些元素的化合价与它们原子的次外层或倒数第三层的部分电子有关);(6)电子层数;(7)最外层电子数。
例1、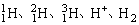 是( )
是( )
A.氢的五种同位素
B.五种氢元素
C.氢的五种同素异形体
D.氢元素的五种不同微粒
解析:
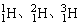 是氢的三种同位素,H+是氢离子,H2是氢元素的单质,构成五种微粒的元素具有相同的核电荷数,故它们可称之为氢元素的五种不同微粒。
是氢的三种同位素,H+是氢离子,H2是氢元素的单质,构成五种微粒的元素具有相同的核电荷数,故它们可称之为氢元素的五种不同微粒。
答案:D
技巧归纳:元素属宏观概念,分子、原子、离子属微观概念。
例2、科学家最近制造出第112号元素,其原子的质量数为277。关于该元素的下列叙述正确的是( )
A.其原子核内中子数和质子数都是112
B.其原子核内中子数为165,核外电子数为112
C.其原子质量是12C原子质量的277倍
D.其原子质量与12C原子质量之比为277︰12
解析:
112号元素原子核内中子数N=277-112=165,A错,B对。其原子质量是指绝对质量为:277×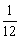 12C,C错
12C,C错
 D对。
D对。
答案:BD
技巧归纳:C选项所说的质量是指原子的绝对质量。
例3、氯只有35Cl和37Cl两种稳定同位素,在氯气中35Cl和37Cl的原子数之比为3︰1。则相对分子质量为70、72、74的氯气分子数之比可能是( )
A.5︰2︰1 B.5︰2︰2
C.9︰3︰1 D.9︰3︰2
解析:
35Cl—35Cl 35Cl—37Cl 37Cl—37Cl
70 72 74
x y z
依题意有:(2x+y)︰(2z+y)=3︰1,即x=y+3z
结论:当z=1时,x=y+3,选A;当z=2时,x=y+6,选D。
答案:AD
例4、甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是( )
A.x+2 B.x+4
C.x+8 D.x+18
解析:
元素周期表有7个周期,16个族,主族是长短周期共同组成的族,同一主族的两元素原子序数差值是有规律的。同A族相邻两周期原子序数差值可能为2、8、18、32等,很显然上下两周期两元素的原子序数的差值不可能为4,即正确答案为B。
答案:B
技巧归纳:熟记元素周期表七个周期元素的种数,背诵元素周期表中一、二、三周期元素名称是解答元素周期表有关问题的关键。
例5、已知:①A、B、C、D四种物质均含元素X,有的还有可能含有元素Y、Z。元素Y、X、Z的原子序数依次递增。
②X在A、B、C、D中都不呈现它的最高化合价。
③室温下单质A与某种常见一元强碱溶液反应。可得到B和C。
④化合物D受热催化分解,可制得元素Y的单质。
(1)元素X是__________,Z是__________。
(2)写出③中反应的化学方程式:____________________。
(3)写出④中反应的化学方程式:____________________。
解析:
由②知x为非金属元素(因X含多种价态),又由③可知单质A与强碱溶液反应,联想Cl2与NaOH溶液的反应进而确定A为Cl2,而X元素则为Cl,又因Z元素原子序数大于X,可推知为K元素,进一步联想KClO3的分解,不难得出正确答案。
答案:
(1)Cl或(氯) K(钾)
(2)Cl2+2KOH=KCl+KClO+H2O
(3)2KClO3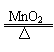 2KCl+3O2↑
2KCl+3O2↑
技巧归纳:熟记元素及其化合物有关化学反应方程式是解答本题的关键。
例6、W、X、Y和Z都是周期表中前20号元素,已知:
①W的阳离子和Y的阴离子具有相同的核外电子排布,且能形成组成为WY的化合物;
②Y和Z属同族元素,它们能形成两种常见化合物;
③X和Z属同一周期元素,它们能形成两种气态化合物;
④W和X能形成组成为WX2的化合物;
⑤X和Y不在同一周期,他们能形成组成为XY2的化合物。
请回答:
(1)W元素是__________;Z元素是__________。
(2)化合物WY和WX2的化学式分别是__________和__________。
(3)Y和Z形成的两种常见化合物的分子式是__________和__________。
(4)写出X和Z形成的一种气态化合物跟WZ反应的化学方程式:___________________。
解析:
由信息①和④可知,W的阳离子带有两个单位的正电荷。Y的阴离子带有两个单位的负电荷,又Y和Z属同族元素,所以Y、Z应分别为O、S中的一种;由信息③和⑤结合上述信息可知,Y为硫,Z为氧,W为钙,X为碳。
答案:
(1)钙 氧 (2)CaS CaC2 (3)SO2 SO3 (4)CO2+CaO=CaCO3
技巧归纳:有关元素位、构、性的综合考查,复习过程中我们应掌握前20号元素在周期表中的位置、原子结构以及有关元素及其化合物的性质,目前这类试题的考查主要是先通过题目信息推断有关元素及其化合物,然后综合考查基本概念(如化学式、化学方程式、电子式书写等)和基本理论。
例7、X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中,Z与Y相邻,Z与W也相邻;
②Y、Z和W三种元素的原子最外层电子数之和为17。
请填空:
(1)Y、Z和W三种元素是否位于同一周期:__________(填“是”或“否”),理由是____________________。
(2)Y是__________,Z是__________,W是__________。
(3)X、Y、Z和W可组成一化合物,其原子个数之比为8︰2︰4︰1。写出该化合物的名称及化学式____________________。
提示:依题意,Y、Z、W在元素周期表中的相对位置只可能有如下两种:
①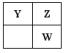 ,设Y的最外层电子数为a,则Z为(A+1),w亦为(a+1),依题意有:
,设Y的最外层电子数为a,则Z为(A+1),w亦为(a+1),依题意有:
a+(a+1)+(a+1)=17,解之:a=5。
则对应三元素为:Y:N;Z:O;W:S。
②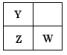 ,则依题意有:a+a+(a+1)=17,a=
,则依题意有:a+a+(a+1)=17,a=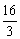 ,不合题意。
,不合题意。
运用方程即寻得解题突破口,则全题可解。
答案:
(1)否最外层电子数之和不可能为17
(2)N O S
(3)硫酸铵(NH4)2SO4
技巧归纳:运用数学思想解答有关元素周期表的有关问题具有直观明了简捷的特点。