一、选择题
1、下列化学反应的离子方程式正确的是( )
A.用稀HNO3溶解FeS固体:FeS+2H+=Fe2++H2S↑
B.少量SO2通入Ca(ClO)2溶液中:
SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
C.在稀氨水中通入过量CO2:NH3·H2O+CO2=NH4++HCO3-
D.氢氧化钙溶液与等物质的量的稀硫酸混合:
Ca2++OH-+H++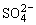 =CaSO4↓+H2O =CaSO4↓+H2O
2、设阿伏加德罗常数(NA)的数值为nA,下列说法正确的是( )
A.1mol Cl2与足量Fe反应,转移的电子数为3nA
B.1.5mol NO2与足量H2O反应,转移的电子数为nA
C.常温常压下,46g的NO2和N2O4混合气体含有的原子数为3nA
D.0.10mol Fe粉与足量水蒸气反应生成的H2分子数为0.10nA
3、研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到直观形象的效果。下列表达不正确的是( )
A.密闭容器中CuO和C高温反应的气体产物:
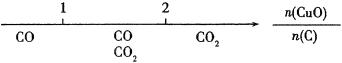
B.Fe在Cl2中的燃烧产物: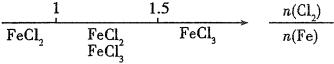
C.AlCl3溶液中滴加NaOH后铝的存在形式:

D.氨水与SO2反应后溶液中的铵盐:
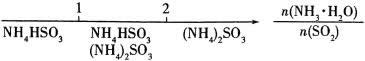
4、下图的装置中,干燥烧瓶内盛有某种气体,烧杯和滴管内盛放某种溶液。挤压滴管的胶头,下列与实验事实不相符的是( )

A.CO2(NaHCO3溶液)/无色喷泉
B.NH3(H2O含酚酞)/红色喷泉
C.H2S(CuSO4溶液)/黑色喷泉
D.HCl(AgNO3)容液/白色喷泉
5、下列离子方程式书写正确的是( )
A.AgNO3溶液中滴入少量的Na2S溶液:2Ag++S2-=Ag2S↓
B.过量CO2通入Ca(ClO)2溶液中:ClO-+CO2+H2O=HCO3-+HClO
C.向Na2CO3溶液中加入过量CH3COOH溶液:CO32-+2H+=CO2↑+H2O
D.向Ba(OH)2溶液中加入少量NaHSO3溶液:
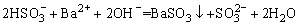
6、在a L Al2(SO4)3和(NH4)2SO4的混合溶液中加入b mol BaCl2,恰好使溶液中的 离子完全沉淀;如加入足量强碱并加热可得到c mol NH3气,则原溶液中的Al3+离子浓度(mol/L)为( ) 离子完全沉淀;如加入足量强碱并加热可得到c mol NH3气,则原溶液中的Al3+离子浓度(mol/L)为( )

7、某温度时,BaSO4在水中的沉淀溶解平衡曲线如下图所示。下列说法正确的是( )
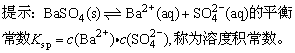
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Kap大于c点对应的Ksp
8、下列反应中氧化剂与还原剂物质的量之比为1︰2的是( )
A.SO2通入Na2S溶液中
B.Na2O2投入Na2S溶液中
C.溴水滴入Na2S溶液中
D.Na2S粉末投入浓H2SO4中
9、下列说法不正确的是( )
A.硫是一种黄色能溶于水的晶体
B.硫的化合物常存在于火山喷出的气体中和矿泉水里
C.硫与氧属于同一主族
D.硫在空气中的燃烧产物是SO2,在纯O2中的燃烧产物是SO3
10、常温常压下,将24mL的H2S和O2混合气用电火花点燃,反应后恢复到常温常压,生成SO2为6mL,则原混合气体中H2S的体积为( )
A.6mL B.8mL
C.10mL D.12mL
11、下列溶液中,不能区别SO2和CO2气体的是( )
①澄清石灰水 ②H2S溶液 ③KMnO4溶液 ④溴水 ⑤酸化的Ba(NO3)2溶液 ⑥品红溶液
A.①②③⑤ B.②③④⑤
C.只有① D.①③
12、向FeCl3和BaCl2的酸性混合溶液中通入SO2气体,有白色沉淀生成,此沉淀是( )
A.BaSO4 B.FeS
C.BaSO3 D.S
13、用密度为1.32g·mL-1的稀H2SO4溶液逐滴滴入BaCl2溶液中至不再产生沉淀为止,已知所生成溶液质量和加入的BaCl2溶液质量相等,则该稀H2SO4溶液的浓度为( )
A.21.9% B.42.1%
C.13.5mol·L-1 D.5.67mol·L-1
14、向盛有氯化钡稀溶液的甲乙两试管中分别通入SO2至饱和,若向甲试管中加入足量的稀HNO3,乙试管中加入足量氢氧化钠溶液,则下列叙述正确的是( )
A.甲、乙两试管都有白色沉淀生成
B.甲、乙两试管都没有白色沉淀生成
C.甲试管没有白色沉淀生成而乙试管有
D.甲试管有白色沉淀生成而乙试管没有
15、将一定量的锌粒投入足量的浓H2SO4中,充分反应后,锌粒完全溶解,生成的SO2和H2(假定浓H2SO4的还原产物只有SO2)混合气体在标准状况下为3.36L,则参加反应的锌的物质的量为( )
A.0.09mol B.0.12mol
C.0.15mol D.0.18mol
[提示]
二、综合题
16、由常见元素组成的化合物A、B、C、D、E、F,有如图所示的转化关系,其中D是氯化物,C是具有臭鸡蛋气味的气体,F气体在空气中形成白雾。据图所示转化关系回答:
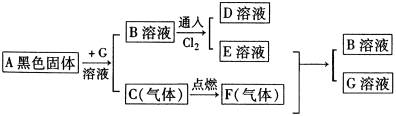
(1)写出下列物质的化学式:
A____________________;B____________________;
C____________________;G____________________。
(2)写出气体F通入E溶液中离子反应方程式(E具有氧化性,F具有还原性):____________________________________________________________;
(3)D溶液中通入气体C产生淡黄色的沉淀且pH减小,用化学方程式表示这一变化过程:____________________________________________________________。
[答案]
17、在硫酸工业中,通过下列反应使SO2氧化成SO3:

(1)在生产中常采用过量的空气是为了________________________________________。
(2)加热到400℃~500℃,可以_____________________________________________。
(3)增大压强,对上述反应有什么影响? ______________________________。为什么工业上常在接近常压下操作? ________________________________________。
(4)常用浓H2SO4而不用水吸收SO3是由于______________________________。
(5)尾气中SO2必须回收是为了________________________________________。
[答案]
18、科学家致力于二氧化碳的“组合转化”技术的研究,把过多二氧化碳转化为有益于人类的物质。
(1)如果将CO2和H2以1︰4的比例混合,通入反应器,在适当的条件下反应,可获得一种重要的能源。请完成以下化学方程式:CO2+4H2→( )+2H2O
(2)若将CO2和H2以l︰3的比例混合,使之发生反应生成某种重要的化工原料和水,该原料可能是( )
A.烷烃 B.烯烃
C.炔烃 D.芳香烃
(3)用CO2和H2可以合成CnH2n+2的烷烃,写出该化学方程式并配平:____________________。
(4)已知在443~473K时,用钴(Co)作催化剂可生成C5~C8的烷烃,这是人工合成汽油的方法之一。要达到该汽油的要求,CO2和H2的体积比的取值范围是多少?
(5)甲、乙、丙三个化肥厂生产尿素所用的原料不同,但生产流程相同:
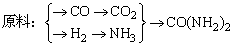
①甲厂以焦炭和水为原料;②乙厂以天然气和水为原料;③丙厂以石脑油(主要成分为C5H12)和水为原料,按工业有关规定,利用原料所制得的原料气H2和CO2的物质的量之比,若最接近合成尿素的原料气NH3(换算成H2的物质的量)和CO2物质的量之比,则对原料的利用率最高。据此判断甲、乙、丙三个工厂哪个工厂对原料的利用率最高?__________。写出合成尿素的热化学方程式________________(生成lmol CO(NH2)2的反应热是127kJ·mol-1,CO(NH2)2为固体,水是气体),请设计工业合成尿素的条件____________________________。
[答案]
19、向含有a mol Na2S和b mol Na2S2O3的混合溶液中慢慢加入足量的稀H2SO4充分反应后生成沉淀x mol和y L气体(标准状况下)试解答:
(1)计算推测当a︰b的取值范围不同时,x、y的值(用a、b的代数式表示)并将气体成分填入下表。
编号 |
a︰b取值范围 |
x |
y |
气体成分(填分子式) |
1 |
|
|
|
|
2 |
|
|
|
|
3 |
|
|
|
|
4 |
|
|
|
|
(2)若x=a+b,写出a与b的函数关系式。
[答案]
20、在标准状况下,将100mL H2S和O2的混合气体点燃,反应后恢复到原状况,发现反应后所得气体总体积V(总)随混合气体中O2所占的体积V(O2)的变化而不同。若气体的体积均在同温同压下测定,试回答下列问题:
(1)以反应后气体总体积V(总)为纵坐标,以氧气在100mL混合气中所占体积V(O2)为横坐标,在下图中画出有关变化图象。
(2)当V(总)=80mL时,反应后气体成分可能是__________;(只填化学式,下同)
(3)当V(总)=20mL时,反应后气体成分可能是__________;
(4)试写出V(总)与V(O2)之间的函数关系式____________________。
[答案]
|