A 卷
开始测试
B 卷
二、综合题
11、为防治酸雨,降低煤燃烧时向大气排放的SO2,工业上将生石灰和含硫煤混合后使用。请写出燃烧时,有关“固硫”(不使硫化合物进入大气)反应的化学方程式:__________,_____________。
[答案]
12、我国农业因遭受酸雨而造成每年损失高达15亿多元。为了有效控制酸雨,目前国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规。
(1)现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下:
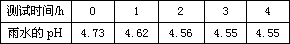
分析数据,回答下列问题:
①雨水样品的pH变化的原因是(用化学方程式表示)_____。
②如果将刚取样的上述雨水和自来水相混合,pH将变______,原因是(用化学方程式表示)_________。
(2)你认为减少酸雨产生的途径可采用的措施是________。
①少用煤作燃料; ②把工厂烟囱造高; ③燃料脱硫;
④在已酸化的土壤中加石灰; ⑤开发新能源
A.①②③ B.②③④⑤
C.①③⑤ D.①③④⑤
(3)在英国进行的一个研究结果表明:高烟囱可以有效地降低地表面SO2浓度。在20世纪的60年代—70年代的10年间,由发电厂排放出的SO2增加了35%,但由于建筑高烟囱的结果,地面浓度降低了30%之多。请你从全求环境保护的角度,分析这种方法是否可取?简述其理由。
[答案]
13、某学生课外活动小组利用下图所示装置分别做如下实验:
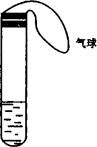
(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是_______溶液;加热时溶液由红色逐渐变浅的原因是:____________________________。
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是__________溶液;加热时溶液由无色变为红色的原因是:______________________________。
[答案]
14、汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的污染源,治理的方法之一是在汽车的排气管上装一个“催化剂转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化。
(1)写出CO与NO反应的化学方程式____________________。
(2)“催化剂转换器”的缺点是在一定程度上提高空气的酸度。其原因是_______________________。
(3)控制城市污染源的方法可以有____________(多选扣分)。
a、开发氢能源 b、使用电动车
c、植树造林 d、戴上呼吸面具
[答案]
15、某无色溶液可能含有下列钠盐中的几种:A、氯化钠;B、硫化钠;C、亚硫酸钠;D、硫代硫酸钠;E、硫酸钠;F、碳酸钠。向此溶液中加入适量稀H2SO4,有浅黄色沉淀析出,同时有气体产生,此气体有臭鸡蛋气味,可使澄清的石灰水变浑浊,不能使品红试液褪色。根据上述实验现象回答下列问题。
(1)不能使品红试液褪色,说明该气体不含_________(填分子式)。
(2)此无色溶液中至少存在哪几种钠盐?请写出全部可能的情况(填写相应的字母)。第一种情况____________,第二种情况____________,第三种情况______________,第四种情况__________(可不填满,也可补充)。
[答案]
|