原子半径和离子半径大小比较规律:
1、同种元素各种粒子:
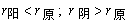
如: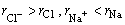 。
。
2、同一周期,从碱金属到卤素,原子半径随原子序数递增而逐渐增大;同一主族,从上到下,原子、离子随电子层数增多,半径越大。
如:F<Cl<Br<I;Li+<Na+<K+<Rb+<Cs+。
3、电子层结构相同的离子,随离子序数增多,离子半径减小。
He型离子:H-、Li+、Be2+
Ne型离子:N3-、O2-、F-、Na+、Mg2+、Al3+
Ar型离子:P3-、S2-、Cl-、K+、Ca2+
如:P3->S2->Cl->K+>Ca2+