A 卷
开始测试
B 卷
二、综合题
11.氮化钠(Na3N)是科学制备的一种重要的化合物,它与水作用可产生NH3。请回答下列问题:
(1)Na3N的电子式是___________,该化合物是由___________键形成的。
(2)Na3N与盐酸反应生成___________种盐;其电子式是__________。
(3)Na3N与水的反应属于__________反应。
(4)比较Na3N中两种粒子半径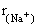 ____ ____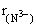 (填“>”、“=”或“<”=。 (填“>”、“=”或“<”=。
[答案]
12. 化合物A是一种不稳定的物质,它的分子组成可用OxFy表示。10mL A气体能分解生成15mLO2和10mLF2(同温、同压下)。
(1)A的化学式是___________推断时的依据是___________________。
(2)已知A分子中x个氧原子呈……O—O—O……键状排列,则A分子的电子式是___________,结构式是___________。
[答案]
13. 下列五种物质中①Ar ②CO2 ③SiO2 ④NaOH ⑤K2S,只存在共价键的是____,只存在离子键的是_____,既存在离子键又存在共价键的是_______,不存在化学键的是______。(填序号)
[答案]
14. A、B、C、D是同一周期的四种元素,A、B、C、D的原子序数依次相差为1。A元素的单质的化学性质活泼,A元素的原子在周期中原子半径最大。B元素的氧化物2.0g恰好跟100mL0.50mol·L-1硫酸完全反应,B元素单质跟D元素单质反应生成化合物BD2。根据以上事实填写下列空白:
A的原子结构示意图______;
C的原子结构示意图_______;
BD2的电子式______。
若向C的氧化物的水化物中加入的A氧化物的水化物,则溶液显碱性。这一反应的化学方程式为___________________。
[答案]
15.(江苏)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
键能 / kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)
SiC______Si;SiCL4_________SiO2
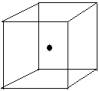
(2)右图立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子。
(3)工业上用高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)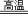 Si(s)+4HCl(g)该反应的反应热△H=_____________kJ / mol Si(s)+4HCl(g)该反应的反应热△H=_____________kJ / mol
[答案]
|