一、硫酸盐及矾
1、硫酸钙(CaSO4)
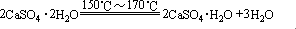
石膏(或生石膏)熟石膏
用途:(1)作石膏模型、石膏绷带。
(2)在水泥工业中加入石膏调节水泥的凝结时间。
2、硫酸钡(BaSO4)
天燃产BaSO4称重晶石。BaSO4具备不溶于水,也不溶于酸,无毒,不易被X射线透过的性质,医疗上常用BaSO4作X射线透视肠胃的内服药剂,欲称“钡餐”。
3、ZnSO4
ZnSO4·7H2O是无色晶体,欲称皓矾。医疗上可作收敛剂,还可作材料的防腐剂(浸枕木)、印染工业上的媒染剂(使染料附着于纤维上)。
4、硫代硫酸纳(Na2S2O3)
Na2S2O3俗称大苏打。有关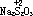 的反应有:
的反应有:
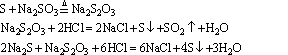
5、矾
矾指的是一些含结晶水的硫酸盐。常见的矾有:
CuSO4·5H2O——胆矾、蓝矾
FeSO4·7H2O——绿矾
ZnSO4·7H2O——皓矾
KAl(SO4)2·12H2O——明矾(又称钾铝矾)
二、氧化性酸和酸的氧化性的区别
所谓氧化性酸是指酸根部分易于获得电子的酸,如浓H2SO4、HNO3等,由于其中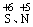 易获得电子,表现出很强的氧化性;而盐酸、氢硫酸、H2CO3、H3PO4等酸根部分不能或不易获得电子,所以它们是非氧化性酸,其中,盐酸、氢硫酸的酸根部分易失电子,在氧化还原反应中作还原剂,故又可叫还原性酸。
易获得电子,表现出很强的氧化性;而盐酸、氢硫酸、H2CO3、H3PO4等酸根部分不能或不易获得电子,所以它们是非氧化性酸,其中,盐酸、氢硫酸的酸根部分易失电子,在氧化还原反应中作还原剂,故又可叫还原性酸。
在水溶液中任何酸都能不同程度地电离出H+,H+在一定条件下可获得电子形成H2,从这一点看,酸都具有氧化性,这是H+的氧化性,它和氧化性酸中中心元素处于高价态易获得电子具有的氧化性是不同的。
区别上述两个概念的关键在于:酸根部分易得电子→有氧化性→氧化性酸;酸电离出H+→有氧化性→酸的氧化性。
三、部分有关环境保护知识
1、环境:大气、土地、水、矿产、森林、生物及风景游览区、自然保护区、生活居住区等构成了人类生存的环境。
2、环境污染:主要包括大气污染、水污染、土壤污染、食品污染等,还包括固体废弃物、放射性、噪声等污染。
3、酸雨:空气中硫的氧化物和氮的氧化物随雨水降下就成为酸雨。其危害有:可使湖泊水质酸化、毒害鱼类和其他水生物;使土壤酸化、破坏农田、损害农作物和森林;腐蚀建筑物、金属制品、名胜古迹等。
4、工业三废:废水、废气、废渣。
5、粉尘:指煤、矿石等固体物料在运输、筛选、粉碎、卸料等机械处理过程中产生的或是由风扬起的灰尘等。
6、破坏臭氧层的物质:SO2、NO、NO2、CF2Cl2(氟利昂)
7、环保措施:控制和减少污染物的排放,如工厂尾气在排放前的回收处理、城市机动车的排气限制等。
8、氰化物:CN-有剧毒(电镀液中常含有),含CN-的污水、废气会严重污染环境。
9、汞:极毒,不慎洒出,可在汞上撒上硫粉(Hg+S=HgS);为了排除室内汞蒸气,排风机应装在墙的下部。
10、Cu、Hg、Pb、Ba、Sn等重金属盐可使人中毒,误食后应立即喝大量生蛋清或生牛奶解毒。
11、NaNO2:有毒,外观类似食盐,易误食,NaNO2进入血液,可把亚铁血红蛋白氧化为高铁血红蛋白,使血液失携氧功能,造成组织缺氧。
12、从能源利用条件看,我国主要的大气污染是煤烟型及SO2和烟尘。