电解质导电的内因和外因及其判断
电解质是化合物。这是因为化合物含有离子或溶于水能生成离子,这就是电解质导电的内因。溶于水或融化是导电的外因。通电后离子定向移动,在电极上发生氧化还原反应是导电的过程和实质,即电解质的导电是离子在外加电场作用下作定向移动的结果。
化合物在融化或溶解于水时能否导电,是判断其是否是电解质的依据,只要具备其中一个条件即可。对于一些难溶的物质(如BaSO4固体),由于溶解度太小,很难测出溶液的导电性,但BaSO4在熔融状态时,能电离出自由移动的离子(Ba2+、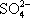 ),因此某些难溶物是强电解质。
),因此某些难溶物是强电解质。
相反,有些物质其水溶液虽能导电,但它们并非电解质。如氨气、二氧化硫溶于水均能导电,但并非它们本身能电离出自由移动的离子,而是它们与水反应的生成物NH3·H2O、H2SO3能电离出离子而导电,所以氨气、二氧化硫都不是电解质。蔗糖、酒精、二氧化碳等是常见的非电解质。