(1)NaHCO3跟HCl反应比Na2CO3跟HCl反应速率快
原因: Na2CO3与盐酸反应是分步进行的
Na2CO3+HCl=NaHCO3+NaCl
NaHCO3+HCl=NaCl+H2O+CO2↑
NaHCO3与盐酸反应一步完成:NaHCO3+HCl=NaCl+H2O+CO2↑
(2)不用任何试剂区别Na2CO3溶液和盐酸
原因:
①往 Na2CO3溶液中逐滴滴加盐酸至过量,反应方程式为:
Na2CO3+HCl=NaHCO3+NaCl
NaHCO3+HCl=NaCl+H2O+CO2↑
现象为:开始阶段无明显现象,最后才有气体放出。
②往盐酸中逐滴滴加 Na2CO3溶液至过量,由于开始时盐酸相对过量,故反应方程式为:
Na2CO3+2HCl=2NaCl+H2O+CO2↑
现象为:开始就有气体放出。
3、Na2CO3与NaHCO3相互转化
(1)正盐  酸式盐
酸式盐
往饱和 Na2CO3溶液中通入CO2,溶液变浑浊,反应方程式为:
Na2CO3+CO2+H2O=2NaHCO3
原因:反应消耗水,溶质的质量增加,在相同条件下 NaHCO3的溶解度比Na2CO3小。
(2)酸式盐  正盐
正盐
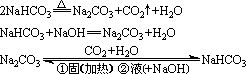
4、Na2CO3和NaHCO3的鉴别
(1)根据热稳定性不同进行鉴别
分别加热少量固体,若产生的气体能使澄清石灰水变浑浊的为 NaHCO3,没有变化的为Na2CO3。
(2)根据与酸反应速率不同进行鉴别
逐滴加入盐酸,反应较慢、开始无气体逸出的为 Na2CO3,反应较快、开始即有气体逸出的为NaHCO3。
(3)根据阴离子不同进行鉴别
分别取其稀溶液,滴加 BaCl2溶液或CaCl2溶液,产生沉淀的为Na2CO3,无明显现象为NaHCO3。
CaCl2+Na2CO3=CaCO3↓+2NaCl
BaCl2+Na2CO3=BaCO3↓+2NaCl
5、Na2CO3和NaHCO3混合物的分离
(1)Na2CO3固体粉末中混有NaHCO3,用加热法。
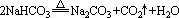
(2)Na2CO3溶液中混有NaHCO3,滴加适量的NaOH溶液。
NaHCO3+NaOH=Na2CO3+H2O
(3)NaHCO3溶液中混有Na2CO3,通入过量的CO2气体。
Na2CO3+CO2+H2O=2NaHCO3
(二)、氢氧化钠(俗称烧碱、火碱、苛性钠)
1、氢氧化钠的物理性质:白色固体,有强吸水性,易潮解,可用作干燥剂。一般将氢氧化钠和生石灰按一定比例熔合制成碱石灰。
2、氢氧化钠的化学性质:强碱,具有碱的通性。
CO2与NaOH溶液反应,NaOH过量时:2NaOH+CO2=Na2CO3+H2O
CO2过量时:NaOH+CO2=NaHCO3
3、氢氧化钠的工业制法
(1)电解法:
(2)土法:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
4、氢氧化钠的保存:密封保存。试剂瓶不能用玻璃塞,应用橡皮塞,因为烧碱能与玻璃成分中的SiO2发生反应:SiO2+2NaOH=Na2SiO3+H2O,生成的Na2SiO3使玻璃塞与瓶口粘结。
(三)、碱金属
碱金属包括:锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)、钫(Fr),由于这些元素氧化物的水化物都是可溶于水的强碱,故称为碱金属。
1、碱金属元素的原子结构特征
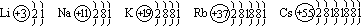
根据以上原子结构示意图分析得出:
相似性:最外电子层上都只有一个电子,次外层电子数为 8个(Li为2个)。
递变性:随着核电荷数增多,电子层数逐渐增多,原子半径逐渐增大。
2、碱金属的物理性质
相似性:都有银白色的金属光泽(除铯略带金色以外),质软,密度小,熔点低,导电、导热性好。
递变性:从 Li到Cs,密度逐渐增大(Li、Na、K的密度比水的小,Rb、Cs的密度比水大,且钠的密度大于钾的密度),熔沸点逐渐降低。
3、碱金属的化学性质
从锂到铯,它们的金属性逐渐增强。
(1)与水反应
相似性:2R+2H2O=2ROH+H2↑ (R为碱金属)
递变性:从锂到铯,金属与水反应的剧烈程度加大,生成的氢氧化物碱性增强( CsOH为最强碱)
(2)与非金属反应
Li:常温或燃烧生成Li2O
4Li+O2=2Li2O
Na:常温生成Na2O,燃烧生成Na2O2
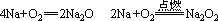
K:常温生成K2O2,燃烧生成KO2(超氧化钾)
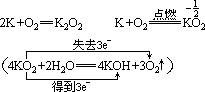
Rb、Cs与氧气反应也生成复杂的氧化物。
(3)与盐溶液反应
碱金属与盐的水溶液反应时,先是与水反应生成碱和氢气,碱再与盐反应。碱金属单质不能从盐的溶液中置换出较不活泼的金属。
4、碱金属的实验室保存方法
Li保存在石蜡油中,Na、K保存在煤油中。
(四)、焰色反应
1、定义:多种金属或它们的化合物在灼烧时使火焰呈现特殊颜色的现象。
2、焰色
锂——紫红色 钠——黄色 钾——紫色(隔着蓝色钴玻璃观察)
铷——紫色 钙——砖红色 锶——洋红色
钡——黄绿色 铜——绿色
3、焰色反应的实质
电子激发后恢复到原状态,以光能的形式释放出能量而显色的物理过程。
4、操作步骤
洗→烧→蘸→烧→观
5、注意事项
(1)火焰最好是无色或浅色,否则会干扰实验的观察。
(2)金属丝本身在火焰上灼烧时应无颜色,同时要求熔点高、不易被氧化。用铂丝效果最好,也可用铁丝、镍丝、钨丝来代替。
(3)金属丝在使用前要用稀盐酸将其表面的氧化物洗净,然后在火焰上灼烧至无颜色。这是因为金属氯化物灼烧时易气化而挥发。
(4)观察钾的焰色时,要通过蓝色的钴玻璃片。这是因为钾的化合物中常混有含钠的杂质,蓝色钴玻璃可以滤去对紫色光有遮盖的黄色光。
6、焰色反应的应用
检验 K、Na等元素的存在。