(3)钠与盐酸反应
2Na+2HCl=2NaCl+H2↑
注意 :
①钠与盐酸反应比钠与水反应更剧烈,其原因为钠无论是和水反应还是和盐酸反应,其实质都是和 H+反应,HCl是强电解质,水为弱电解质,即盐酸中的H+浓度远大于H2O提供的H+浓度,故钠投入盐酸中,直接与盐酸反应,且比与水反应剧烈。
②若盐酸浓度较大,还会出现白色浑浊,其原因为生成的 NaCl在浓盐酸中溶解度不大。
(4)钠与盐溶液反应
●钠与 CuSO4溶液反应
2Na+2H2O=2NaOH+H2↑ ①
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4 ②
①+②得总反应为:
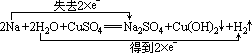
●钠与 FeCl3溶液反应:
2Na+2H2O=2NaOH+H2↑ ①
FeCl3+3NaOH=Fe(OH)3↓+3NaCl ②
①×3+②×2得总反应为:

●钠与 NH4Cl溶液反应:
2Na+2H2O=2NaOH+H2↑ ①
NH4Cl+NaOH=NaCl+NH3↑+H2O ②
①+②×2得总反应为:
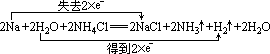
注意 :钠与盐溶液反应,实质上先与水反应,生成的 NaOH再与盐反应,而不能置换出不活泼金属,在反应中钠作还原剂,H2O作氧化剂。
3、钠在实验室中保存方法
实验室中的少量钠需保存在煤油中,避免与空气和水接触。
4、钠的制备

5、钠的存在
钠的性质很活泼,在自然界里不能以游离态形式存在,只能以化合态形式存在,有 NaCl、Na2SO4、Na2CO3、NaNO3等。
6、钠的重要用途
(1)制取钠的重要化合物,如Na2O2;
(2)钠、钾合金在室温下呈液态,是原子反应堆的导热剂;
(3)作冶炼某些金属的还原剂,如: ;
;
(4)用在电光源上,制高压钠灯。
例、把一小块金属钠暴露在空气中,观察到以下现象:
①金属钠表面逐渐变暗;
②过一段时间以后又逐渐变潮湿;
③再过一段时间又转变成白色固体;
④白色固体最终变成白色的粉末。
写出以上发生的各种现象的有关化学方程式。
解析:钠露置于空气中的变化过程是
Na → Na2O → NaOH → Na2CO3·10H2O → Na2CO3(风化)
答案:① 4Na+O2=2Na2O
② Na2O+H2O=2NaOH
③ 2NaOH+CO2+9H2O=Na2CO3·10H2O
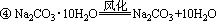
(二)、氧化钠和过氧化钠
注意 :
1、Na2O2不属碱性氧化物。
原因:碱性氧化物与水反应生成碱,与酸反应生成盐和水,而 Na2O2与水反应不仅生成碱,还生成O2,与酸反应不仅生成盐和水,还生成O2。
2、Na2O2在与水、二氧化碳、稀盐酸的反应中,既作氧化剂又作还原剂。
3、Na2O2具有强的氧化性,因此可作漂白剂,能漂白品红试液(一种色素)和酸碱指示剂(如石蕊、酚酞等)。
(三)、氢化钠
钠与 H2在一定条件下反应,可生成离子化合物  ,NaH是很强的还原剂。
,NaH是很强的还原剂。
