1、规律
(1)相同条件下,相同物质的量的不同物质所占的体积:固体<液体 气体。
气体。
(2)相同条件下,相同物质的量的气体体积近似相等,而固体、液体却不相等。
(3)0℃、101kPa时,1mol 任何气体所占的体积都约为22.4L。
2、决定物质体积大小的因素
(1)物质所含粒子数的多少;
(2)物质粒子本身的大小;
(3)粒子之间的距离。
当物质的物质的量一定时,由于固态物质或液态物质中粒子间的距离很小,这使得固态物质或液态物质的体积主要决定于粒子的大小,而不同物质其粒子的大小不同,故相同物质的量的固体,液体体积各不相等。
当物质的物质的量一定时,由于气体物质中分子之间的距离约是分子直径的 10倍,这使得气态物质的体积主要决定于气体分子的距离,而当温度、压强一定时,不同气体分子之间的距离可以看作是相等的,故相同物质的量的气体体积在一定温度和压强下近似相等。
3、影响气体分子间距离在小的因素
(1)温度
温度升高,气体分子间的距离增大,气体体积增大;
温度降低,气体分子间的距离减小,气体体积减小。
(2)压强
压强增大,气体分子间的距离减小,气体体积减小;
压强减小,气体分子间的距离增大,气体体积增大。
(二)、气体摩尔体积(Vm)
1、定义:单位物质的量的气体所占的体积。
2、符号:Vm
单位: L/mol或m3/mol
3、在标准状况(0℃、101kPa)下,Vm≈22.4L/mol
(1)只适用于气体,不适用于固体、液体
如:在标准状况下, 1mol Fe的体积为7.2cm3。
(2)气体组分可以是一种,也可以是几种(互不反应)
如:在标准状况下, 1摩尔空气的体积约为22.4L。
(3)是“约为”,而不是“等于”
(4)22.4L/mol并不是特指标准状况下的气体摩尔体积,当压强为202kPa,温度为546K时,气体摩尔体积也约为22.4L/mol。
4、计算公式: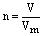
(三)、阿伏加德罗定律及其推论
1、阿伏加德罗定律
在相同温度和压强下,相同体积的任何气体都含有相同数目的分子。
2、推论(仅适用于气体)
可由阿伏加德罗定律推出,也可由理想气体状态方程导出: PV=nRT。
[其中:P—压强 V—气体体积 n—气体的物质的量 R—常数 T—热力学温度,T=273+t(t为摄氏温度)]
(1)同温、同压下,气体的体积与其物质的量成正比
即 T、P相同时,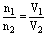
(2)同温、同压下,气体的密度与其摩尔质量成正比
即 T、P相同时,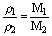
推断过程:由 PV=nRT,可得:
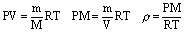
T、P相同时,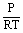 为定值,故
为定值,故 。
。
(3)同温、同体积下,气体的压强与其物质的量成正比
即 T、V相同时,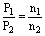 。
。
(4)同温、同压下,体积相同的气体,质量与其摩尔质量成正比
即 T、P、V相同时,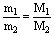 。
。
(5)同温、同压下,质量相等的气体,体积与其摩尔质量成反比
即 T、P、m相同时,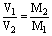
(6)同温、同体积下,等质量的气体,压强与其摩尔质量成反比
即 T、V、m相同时,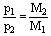
(四)、相对密度(D)
气体在某一温度、压强的条件下,气体 A与气体B的密度比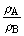 叫做A对B的相对密度,即
叫做A对B的相对密度,即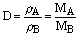 。
。
(五)、平均摩尔质量(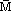 )及平均相对分子质量(
)及平均相对分子质量(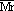 )
)
对于某种纯净物,有摩尔质量和相对分子质量的说法,而对于某种混合物,无论是气体,还是固体、液体,有平均摩尔质量和平均相对分子质量的说法。
1、平均摩尔质量(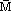 )的求法
)的求法
(1)已知混合物的总质量[m(混)]和总物质的量[n(混)],则:
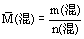
(2)已知标准状况下混合气体的密度[ρ(混)],则:
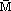 (混)=22.4L/mol·ρ(混)
(混)=22.4L/mol·ρ(混)
(3)已知同温、同压下混合气体的密度[ρ(混)]是一种简单气体A的密度的倍数D(即混合气体对气体A的相对密度为D),则:
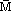 (混)=D×M(A)
(混)=D×M(A)
(4)已知混合物中各组分的摩尔质量和其物质的量分数(n1%、n2%、…)或体积分数(V1%、V2%、…),则:
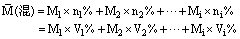
推断过程:若混合气体有i种组分,其摩尔质量分别为M1、M2、…、Mi,其物质的量分别为n1、n2、…、ni,其体积分别为V1、V2、…、Vi,则:
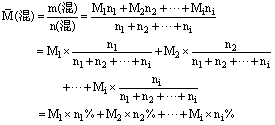
由阿伏加德罗定律推论可知: ni%=Vi%,故:
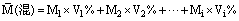
2、平均相对分子质量(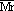 )的求法
)的求法
由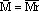 g/mol,可求得
g/mol,可求得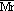 。
。
3、应用
(1)求空气的平均相对分子质量
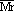 (空气)≈32×20%+28×80%≈29。
(空气)≈32×20%+28×80%≈29。
(按 O2的体积分数为20%,N2的体积分数为80%,近似计算)
(2)排空气法收集气体
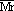 >29时,ρ>ρ(空气),可用向上排空气法收集;
>29时,ρ>ρ(空气),可用向上排空气法收集;
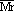 ≈29时,ρ≈ρ(空气),一般用排水法收集;
≈29时,ρ≈ρ(空气),一般用排水法收集;
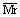 <29时,ρ<ρ(空气),一般用向下排空气法收集。
<29时,ρ<ρ(空气),一般用向下排空气法收集。
(六)气体摩尔体积的计算
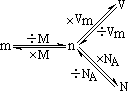
(标准状况下Vm=22.4L/mol)