请回答:
(1)写出A、B和C的化学式:A_______________,B_______________,C_______________。
(2)依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式:______________________,____________________________。
(3)写出将SO2气体通入K溶液中发生反应的离子方程式:_____________________________________________
(4)写出由F→H的化学方程式:___________________________________________。
答案:
(1)NaI;NaClO; AgI
(2)2I-+ClO-+H2O=I2+Cl-+2OH-
I2+5ClO-+2OH-=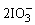 +5Cl-+H2O
+5Cl-+H2O
(3)2Fe3++SO2+2H2O=2Fe2++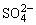 +4H+
+4H+
(4)Cl2+2NaOH=NaClO+NaCl+H2O
解析:
(1)不溶于水及HNO3的黄色沉淀应为AgI,由此可推知A为NaI,在CCl4中呈紫色的是单质碘,因此D为I2,能将NaI转化成I2的物质应具有氧化性,B应是一种常见的氧化剂,黄绿色气体应是Cl2,因此溶液中F为Cl2,Cl2与FeCl2的反应产物为FeCl3,Cl2通入NaOH溶液中反应为:Cl2+2NaOH=NaCl+NaClO+H2O,由以上分析可知B为NaClO。
(2)A为NaI,B为NaClO,I-氧化产物为I2,ClO-还原产物为Cl-,离子方程式应为:2I-+ClO-+H2O=I2+Cl-+2OH-,当I2与NaClO作用时,ClO-仍然被还原成Cl-,依题意I2被氧化成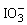 ,离子方程式为:5ClO-+I2+2OH-=5Cl-+2
,离子方程式为:5ClO-+I2+2OH-=5Cl-+2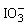 +H2O
+H2O
(3)K溶液中含FeCl3、SO2有还原性,氧化产物为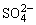 ,Fe3+有氧化性,还原产物为Fe2+,其离子方程式为:2Fe3++SO2+2H2O=2Fe2++
,Fe3+有氧化性,还原产物为Fe2+,其离子方程式为:2Fe3++SO2+2H2O=2Fe2++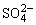 +4H+
+4H+
(4)Cl2与NaOH溶液反应,中学化学中用于实验室制备Cl2尾气的吸收,其反应式为:Cl2+2NaOH=NaCl+NaClO+H2O,按框图转化关系: