|
相对原子质量:H:1 C:12 N:14 O:16 F:19 Na:23 Mg:24
Al:27 Cl:35.5 K:39 Ca:40 Mn:55 Ag:108 I:127
第I卷(选择题,共54分)
一、选择题(本题包括 18小题,每小题只有一个选项符合题意,每小题3分,共54分)。
1、下列物质中存在Cl-离子的是( )
A.氯酸钾溶液 B.次氯酸钠溶液
C.液氯 D.氯水
2、下列物质具有漂白性的是( )
A.干燥的氯气 B.潮湿的氯气
C.干燥的次氯酸钙 D.氯化钙
3、从碘水中提取碘,不能用的试剂是( )
A.酒精 B.汽油
C.四氯化碳 D.苯
4、欲除去二氧化碳中含有的少量HCl气体,可以使混合气体通过( )
A.氢氧化钠溶液 B.氢氧化钙溶液
C.饱和碳酸氢钠溶液 D.饱和碳酸钠溶液
5、下列各微粒中,既具有氧化性又具有还原性的是( )
A.Al B.Cl-
C.Cu2+ D.Fe2+
6、下列氯化物中,既能由金属和氯气直接反应制得,又能由金属和盐酸反应制得的是( )
A.CuCl2 B.FeCl2
C.FeCl3 D.AlCl3
7、用0.1mol·L-1的硫酸钠溶液,0.2mol·L-1的硫酸铁溶液及蒸馏水三种混合起来,并使混合后溶液中Na+、Fe3+、SO42-浓液依次为0.1mol·L-1、0.1mol·L-1、0.2mol·L-1(设混合溶液的体积是三种溶液体积之和),则Na2SO4、Fe2(SO4)3和蒸馏水三体积之比为( )
A.2:1:1 B.1:2:1
C.2:1:2 D.1:1:2
8、下列对氯水的叙述正确的是( )
A.新制氯水只含有Cl2和H2O分子
B.新制氯水可使蓝色石蕊试纸先变红后褪色
C.光照氯水有气泡产生,该气体是Cl2
D.氯水放置数天后,溶液pH将增大
9、用MnO2与浓盐酸反应制取Cl2,当有4mol HCl被氧化时,生成的Cl2在标准状况下的体积是 ( )
A.22.4L B.11.2L
C.44.8L D.89.6L
10、甲、乙、丙三种液各含有一种X-(Cl-、Br-、I-)。向甲中加淀粉溶液和氯水,则溶液变为橙色,再加丙溶液,颜色无明显变化。则甲、乙、丙依次含有( )
A.Br-、Cl-、I- B.Br-、I-、Cl-
C.I-、Br-、Cl- D.Cl-、I- 、Br-
11、食用加碘盐可以预防碘缺乏病,因为碘盐含有( )
A.碘元素 B.碘单质
C.铁元素 D.锌元素
12、向NaI和KI混合溶液中加入AgNO3溶液,直到反应完全为止,结果反应后溶液的质量恰好等于原混合溶液的质量。该硝酸银溶液的质量分数为( )
A.50% B.38.20%
C.72.30% D.48.8%
13、为了增强漂白粉的漂白能力,常在漂白粉溶液中加入少量的( )
A.NaOH B.NaCl
C.HCl D.Ca(ClO)2
14、用自来水养金鱼之前,需把水先在阳光下暴晒一段时间的目的是( )
A.增加水中O2含量 B.提高水温
C.紫外线杀菌消毒 D.消去HClO
15、储存氯气的钢瓶,为防止腐蚀,装氯气前必须( )
A.消洗干净 B.充入惰性气体
C.充分干燥 D.除去铁锈
16、市售家用消毒液发生器是化学知识在日常生活中的“创新”应用。该发生器利用常见的精盐和自来水为反应物。通电时,电解槽内的极板上产生大量气泡;切断电源后所得消毒液具有强烈的杀菌能力,且对人体无害。跟该发生器直接有关的化学反应是( )
① 
② H2+Cl2=2HCl
③ Cl2+2NaOH=NaClO+NaCl+H2O
④ Cl2+H2O=HCl+HClO
⑤ 2HClO=2HCl+O2↑
A.①④ B.①②⑤
C.①③ D.①④⑤
17、把含有某一种氯化物杂质的MgCl2粉末95mg溶于水后,与足量AgNO3溶液反应,生成AgCl沉淀300mg。则该氯化镁中杂质可能是( )
A.NaCl B.AlCl3
C.KCl D.CaCl2
18、下列离子方程式书写正确的是( )
A.氯气与水的反应:Cl2+H2O=2H++Cl-+ClO-
B.向漂白粉溶液中通入过量的二氧化碳ClO-+CO2+H2O=HCO3-+HClO
C.二氧化锰和浓盐酸反应:MnO2+4HCl(浓)=Mn2++2Cl-+Cl2+2H2O
D.溴化钠与氯水反应:Br-+Cl2=Br2+2Cl-
[提示] 第Ⅱ卷(非选择题,共 46分)
二、实验题(本题包括 2小题,共14分)
19、(6分)下图是某学生设计的验证氯气有无漂白作用与制取饱和氯水的实验装置,试回答下列问题:
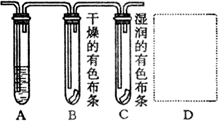
(1)装置A中溶液是___________,其作用是___________;
(2)装置B、C中的实验现象是_______________,由此得出的结论是____________________;
(3)在方框D中,画出制取饱和氯水的实验装置图。
20、(8分)实验室里用所给仪器(如图)组装实验装置制备纯净的无水CuCl2。回答下列问题:
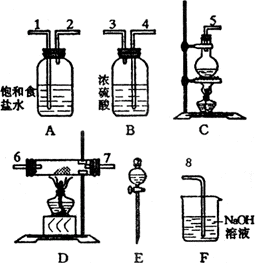
(1)组装氯气发生装置,应选用的仪器是___________,E的名称是___________。
(2)按Cl2气流方向,其余装置的连接顺序(用数字1、2、…填入)是:
( )→( )→( )→( )→( )→( )→( )→( )
(3)实验前检查整套装置的气密性的方法是:_____________________________________。
(4)装置A的作用是___________,装置B的作用是___________。
(5)装置F的烧杯中盛___________(名称),其作用是___________,反应方程式是______________________。
(6)待充分反应后,装置D的玻璃管中剩余物呈___________色,将制得的产物配制成饱和溶液,呈___________色。
[答案] 三、填空题(本题包括 4小题,共20分)
21、(6分)有X、Y、Z三种常见元素,已知:
① X、Y、Z单质在通常情况下均为气体;
② X单质可在Z单质中燃烧火焰呈苍白色,反应生成化合物XZ
③ XZ易溶于水,其水溶液可使蓝色石蕊试纸变红
④ X2和Y2在一定条件下能化合生成X2Y,X2Y在常温下为无色液体
⑤ Z单质可溶于X2Y所得溶液具有漂白作用
据此推断分析:
(1)X为_________,Y为_________,Z为________(填元素名称)
(2)反应生成物的化学式:XZ为___________,X2Y为___________
(3)反应②的化学方程式为______________________。
22、(2分)(1)将足量CO2气体通过1mol Na2O2后,Na2O2固体质量将变为________g。
(2)将VL CO2气体通过足量的Na2O2后,体积变为(在相同条件下)___________。
[答案]
23、(2分)有NaCl、CaCl2、AlCl3三种溶液,若溶质的物质的量相等,分别与足量的硝酸银溶液反应,则生成沉淀的物质的量之比为___________。若生成的沉淀的质量相等,则三种溶液中溶质的物质的量之比为_______。
24、用合适的试剂把下列物质中含有的少量杂质(括号中)除去,写出选用的试剂和有关反应的方程式(若不需试剂写出操作方法)。
(1)KCl(KI),试剂___________,离子方程式_________________。
(2)H2(Cl2)试剂___________,离子方程式____________________。
(3)NaCl(I2)___________。
(4)NaCl(Na2SO4)试剂___________,离子方程式_________________。
[答案] 四、计算题(本题包括 2小题,共12分)
25、(6分)用21.75g MnO2质量分数为80%的软锰矿与足量的浓盐酸作用,生成的气体与足量的H2化合,最后全部通过AgNO3溶液(足量),求生成AgCl的质量是多少。
[答案]
26、(6分)为实现中国2000年消除碘缺乏病的目标,卫生部规定食盐必须加碘,其中的碘以碘酸钾(KIO3)的形式存在。已知在溶液中IO3-和I-发生反应:IO3-+5I-+6H+=3I2+3H2O,我们可以依据此反应和淀粉-KI试纸检测食盐中是否存在IO3-,也可以定量检测食盐中KIO3的含量。若取质量为30g的食盐样品配成500mL溶液,测得c(NaCl)=1mol·L-1,试确定KIO3在食盐中的质量分数。
[答案]
- 返回 -
|