例1、(江苏)较低温度下,氯气通入石灰乳中可制得漂白粉,该反应为放热反应。某校甲、乙两化学研究性学习小组均用200mL 12mol/L盐酸与17.4g MnO2在加热条件下反应制备氯气,并将制备的氯气与过量的石灰乳反应制取漂白粉,用稀氢氧化钠溶液吸收残余的氯气。分析实验结果发现:① 甲、乙两组制得的漂白粉中Ca(ClO)2的质量明显小于理论值,② 甲组在较高温度下将氯气与过量的石灰乳反应,所制得的产品中Ca(ClO3)2的含量较高。试回答下列问题:
(1)上述实验中理论上最多可制得Ca(ClO)2多少克?
(2)实验中所得到的Ca(ClO)2的质量明显小于理论值,试简要分析其可能原因,并写出可能涉及到的化学方程式。
解析:
(1)根据题意,n(HCl)=12 mol/L×0.2L=2.4mol
n(MnO2)=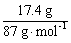 =0.2mol
=0.2mol
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
n(HCl)︰n(MnO2)=2.4︰0.2=12︰1>4︰1
所以浓盐酸过量,应根据MnO2计算。
根据制备氯气的化学方程式
n(Cl2)=n(MnO2)=0.2mol
又因为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
n[Ca(ClO)2]= n(Cl2)=0.1 mol
n(Cl2)=0.1 mol
m[Ca(ClO)2]=143g/mol×0.1mol=14.3g
(2)① 随着反应进行,温度升高,会产生副产物Ca(ClO3)2
6Cl2+6Ca(OH)2 5CaCl2+Ca(ClO3)2+6H2O
5CaCl2+Ca(ClO3)2+6H2O
② Cl2未与石灰乳完全反应,残余氯气被NaOH溶液吸收,
Cl2+2NaOH=NaCl+NaClO+H2O