(一)、物质的量(n)
物质的量是以阿伏加德罗常数个微粒为计数单位的物理量,单位为“摩尔”或“ mol”。
1、“物质的量”是一个专用名词,不能拆开理解;
2、“物质的量”描述的对象是微观粒子集体,微粒可以是分子、原子、离子、质子、中子、电子或它们特定的组合。
(二)、阿伏加德罗常数(NA)
阿伏加德罗常数是 0.012kg 12C所含的碳原子数,它是物质的量的计量基准,单位为“mol-1”。
例:计算:已知一个12C原子的质量为1.993×10-26kg,求0.012kg 12C所含的原子数为多少?
解析: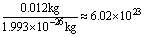
1、 NA 是精确值,随着称量方法和称量工具的不断改进,它将越来越准确,而6.02×1023mol-1是它的近似值。
2、 NA 作为物质的量的基准, 1mol任何粒子的粒子数叫阿伏加德罗常数。
(三)、摩尔(mol)
摩尔是表示物质的量的单位,是国际单位制的 7个基本单位之一,简称摩。0.012kg 12C所含的碳原子数规定为1mol,这样1摩任何物质既有确定的粒子数目,又有确定的质量。摩尔像一座桥梁把一定数目的微观粒子与可称量的物质联系起来。
1、在使用摩尔表示物质的量时,应该用化学式指明微粒的种类,而不使用该微粒的中文名词。
2、摩尔只适用于微观粒子,不能用于宏观物质。
3、在叙述或定义“1摩尔”时要用阿伏加德罗常数,在计算时,通常采用6.02×1023mol-1这个近似值.
(四)、粒子数(N)与其物质的量关系
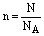
例:1.5mol H2SO4 中约含有 3×6.02×1023 个H、1.5×6.02×1023 个S、6×6.02×1023 个 O 、 1.5×6.02×1023 个H2SO4;若将1.5mol H2SO4 溶于水,则水溶液中约含有3×6.02×1023 个H+、1.5×6.02×1023 个SO42-。
(五)、摩尔质量(M)
1、定义:单位物质的量的物质所具有的质量叫做摩尔质量。
2、单位:g/mol或kg/mol。
3、1mol 任何粒子或物质的质量以克为单位时,在数值上都与该粒子的相对原子质量或相对分子质量相等。即摩尔质量的单位为g·mol-1时,M=Mr g·mol-1。
推断:由相对原子质量的定义可知:
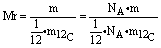 ,因为1mol 12C的质量为12g,
,因为1mol 12C的质量为12g,
即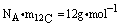 ,故:
,故:
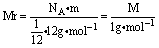
M=Mr g·mol-1
4、粒子的摩尔质量表示方法
(1)对于原子来说,1mol任何原子的质量以克为单位时,在数值上等于该种原子的相对原子质量;
(2)对于分子来说,1mol任何分子的质量以克为单位时,在数值上等于这种分子的相对分子质量。
(3)对于离子来说,由于电子的质量过于微小,仅为原子质量的1/1836,因此原子在得到或失去电子后的质量近似等于原子的质量,所以,
对于简单离子来说, 1mol任何离子的质量以克为单位时,在数值上等于形成该离子的原子的相对原子质量;
对于较复杂的离子,如原子团来说, 1mol任何原子团的质量以克为单位时,在数值上等于构成该原子团的原子的相对原子质量之和。
(六)、物质的质量与物质的量的关系
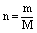
(七)、化学方程式中计量数与物质的量之间的关系
以“ H2与O2反应生成H2O”为例:
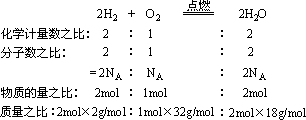
由此可得出:一个化学方程式可表示出化学计量数之比、粒子个数比、粒子的物质的量之比、粒子的质量之比,其中化学计量数之比等于粒子个数比,也等于粒子的物质的量之比。
- 返回 -