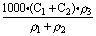1.在100mL 0.10mol·L-1的AgNO3溶液中加入100mL溶有2.08g BaCl2的溶液,再加入100mL溶有0.010mol CuSO4·5H2O的溶液,充分反应。下列说法中正确的是( )
A.最终得到白色沉淀和无色沉淀
B.最终得到的白色沉淀是等物质的量的两种化合物的混合物
C.在最终得到溶液中,Cl-的物质的量为0.02mol
D.在最终得到溶液中,Cu2+的物质的量浓度为0.01 mol·L-1
2.等体积硫酸铝、硫酸锌、硫酸钠溶液分别与足量的氯化钡溶液反应。若生成的硫酸钡沉淀的质量比为1︰2︰3,则三种硫酸盐溶液的物质的量浓度比为( )
A.1︰2︰3 B.1︰6︰9
C.1︰3︰3 D.1︰3︰6
3.质量分数为a的某物质的溶液m g与质量分数为b的该物质的溶液n g混合后,蒸发掉p g水,得到的溶液每毫升质量为q g,物质的量浓度为c。则溶质的分子量(相对分子质量)为( )
A.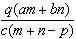 B.
B.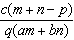
C.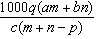 D.
D.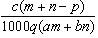
4.浓度为0.50mol·L-1的某金属阳离子Mn+的溶液10.00mL,与0.40mol·L-1的NaOH溶液12.50mL完全反应,生成沉淀,则n等于( )
A.1 B.2
C.3 D.4
5.已知某溶液的①体积;②密度;③溶质和溶剂的质量比;④溶质的摩尔质量,要根据溶质的溶解度计算其饱和溶液的物质的量浓度时,上述条件中必不可少的是( )
A.①②③④ B.①②③
C.②④ D.①④
6、0.5L 1mol/L的FeCl3溶液与0.2L 0.3mol/L的HCl溶液中Cl-的物质的量浓度比为( )
A.10∶1 B.5∶2
C.1∶0.3 D.3∶1
7、在标准状况下,将aL A气体(其摩尔质量为bg·mol-1)溶于0.1L 水中,所得溶液的密度为cg·cm-3,则该溶液中溶质的物质的量浓度为( )
A.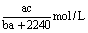 B.
B.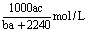
C.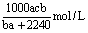 D.
D.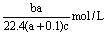
8、相对分子质量为M的化合物在常温下的溶解度为a,此时测得饱和溶液的密度为bg/cm3,则该饱和溶液中溶质的物质的量浓度为( )
A.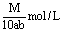 B.
B.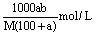
C.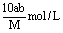 D.
D.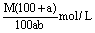
9、在VL硫酸铝溶液中,含有Wg Al3+,这种溶液中SO42-的物质的量浓度是( )
A.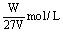 B.
B.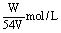
C.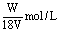 D.
D.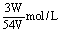
10、两种硫酸溶液,一种硫酸溶液的物质的量浓度为C1,密度为ρ1;另一种硫酸溶液的物质的量浓度为C2,密度为ρ2,它们等体积混合后,混合液的密度为ρ3,混合后硫酸的物质的量浓度为( )
A.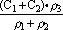 B.
B.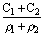
C.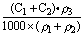 D.
D.