|
第I卷(选择题,共49分)
一、选择题(本题包括 5小题,每小题2分,共10分。每小题只有一个选项符合题意)
1、下列物质中所含分子数目最多的是( )
A.0.5mol CO2 B.6.02×1022个水分子
C.常温常压下11.2LH2 D.20g CO
2、下列溶液中的Cl-浓度与50mL 1mol·L-1氯化铝溶液中Cl-浓度相等的是( )
A.150mL 1mol·L-1氯化钠溶液 B.75mL 1mol·L-1氯化镁溶液
C.150mL 3mol·L-1氯化钾溶液 D.50mL 3mol·L-1氯化钙溶液
3、在标准状况下,与8g SO2所占体积相同的氧气的质量是( )
A.8g B.16g
C.4g D.2g
4、将500mL、0.5mol·L-1的盐酸与100mL、0.2mol·L-1的盐酸混合均匀后,所得溶液中溶质的物质的量浓度为( )
A.0.45mol·L-1 B.0.045mol·L-1
C.0.46mol·L-1 D.0.046mol·L-1
5、相同温度和压强条件下,下列气体中密度最小的是( )
A.CO2 B.NO2
C.N2 D.H2S
[提示]
二、选择题(本题包括 8小题,每小题3分,共24分。每小题有一个或两个选项符合题意)
6、NA为阿伏加德罗常数的值,下列关于0.2mol·L-1K2SO4溶液的正确说法是( )
A.500mL 溶液中所含K+、SO42-总数为0.3NA
B.500mL 溶液中含有0.1NA个K+
C.1L 溶液中K+离子浓度是0.4mol·L-1
D.2L溶液中SO42-离子浓度是0.4mol·L-1
7、下列说法中错误的是( )
A.从1L 1mol·L-1的NaCl溶液中取出10mL,其浓度仍是1mol·L-1
B.制成0.5L 10mol·L-1的盐酸,需要氯化氢气体11.2L(标准状况)
C.0.5L 2mol·L-1BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023
D.10g 98%硫酸(密度为1.84g·cm-3)与10mL 18.4mol·L-1硫酸的浓度是不同的
8、下列说法中正确的是( )
A.标准状况下,1mol H2O的体积是22.4L
B.1mol 任何气体体积均为22.4L
C.0.3mol N2与0.7mol O2的混合气体在标准状况下的总体积约为22.4L
D.1mol N2在25℃和101kPa时,体积约为22.4L
9、将一定量a%的NaOH稀溶液加热蒸发掉bg水,得到溶液体积为VmL,溶质的质量分数为2a%。蒸发后所得溶液中溶质的物质的量浓度为( )
A.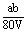 mol·L-1 B. mol·L-1 B. mol·L-1 mol·L-1
C.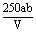 mol·L-1 D. mol·L-1 D.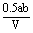 mol·L-1 mol·L-1
10、下列关于摩尔质量的叙述正确的是( )
A.摩尔质量是1mol物质的质量
B.以g·mol-1为单位时,在数值上摩尔质量与相对分子质量或相对原子质量相等
C.水的摩尔质量等于NA个水分子的相对分子质量之和
D.单位物质的量的物质所具有的质量叫摩尔质量
11、在Na2SO4和Al2(SO4)3的混合溶液中,已知其中Al3+的浓度是0.1mol·L-1,SO42-的浓度是0.3mol·L-1,则混合液中Na+的浓度为( )
A.0.15mol·L-1 B.0.3mol·L-1
C.0.45mol·L-1 D.0.6mol·L-1
12、将25g硫酸铜晶体溶于85g水中,形成密度为1.18g·mL-1的溶液,其溶液浓度表示正确的是( )
A.1.1mol·L-1 B.0.1mol·L-1
C.25% D.16%
13、下列说法中正确的是( )
A.摩尔既是物质的数量单位又是物质的质量单位
B.物质的量既表示物质的数量又表示物质的质量
C.阿伏加德罗常数是12kg12C中含有的碳原子数目
D.1mol H2O中含有2mol H和1mol O
[提示] 三、选择题(本题包括 5小题,每小题3分,共15分。每小题只有一个选项符合题意)
14、CS2(液体)能在氧气中燃烧生成CO2和SO2,将0.228g CS2在448mL(标准状况)O2中燃烧,将燃烧后的混合气体恢复到标准状况时体积为( )
A.112mL B.448nmL
C.224mL D.336mL
15、19% MgCl2溶液中的Cl-和水分子数之比为( )
A.4:90 B.4:45
C.2:45 D.19:81
16、在标准状况下,称量一个充满Cl2的容器,质量为74.6g,若改充N2,其质量为66g,则容器的容积为( )
A.11.2L B.5.6L
C.4.48L D.2.24L
17、将标准状况下aL HCl(气态)溶于1000g 水中,得到盐酸的密度为bg/cm3,则该盐酸的物质的量浓度为( )
A.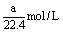 B. B.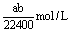
C.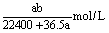 D. D.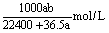
18、某物质A在一定条件下分解2A(g)=B(g)+2C(g)+2D(g),若测得生成的混合气体对H2的相对密度是d,则A的相对分子质量为( )
A.5.0d B.2.5d
C.3.5d D.7.0d
[提示] 第Ⅱ卷(非选择题,共 51分)
四、(本题包括 2小题,共16分)
19、(8分)欲配制500mL 0.5mol·L-1H2SO4溶液。
(1)从下列仪器中选出实验所需要的仪器或用品________(填序号)。
A、500mL 烧杯 B、25mL 量筒 C、50mL量筒
D、500mL容量瓶 E、1000ml容量瓶 F、托盘天平
除选用上述仪器外,尚缺少的仪器或用品是 _________________。
(2)实验中所用的试剂是98%,密度为1.84g·cm-3的浓硫酸和蒸馏水,配制时,需取该浓硫酸_______mL。
(3)配制时,先要检查容量瓶是否漏水,其方法是________________。
(4)浓硫酸溶于水的正确操作方法是________________。
[答案]
20、(8分)实验室配制500mL 0.2mol·L-1的FeSO4溶液,实验操作步骤有:
①在天平上称出 27.8g FeSO4·7H2O,把它放在烧杯里,用适量的蒸馏水使它完全溶解。
②把制得的溶液小心地注入 500mL容量瓶中。
③继续向容量瓶中加蒸馏水至液面距刻度 1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切。
④用少量蒸馏水洗涤烧杯和玻璃棒 2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀。
⑤将容量瓶塞塞紧,充分摇匀。
请填写下列空白:
(1)操作步骤的正确顺序为(填序号)________________。
(2)本实验用到的基本仪器有________________。
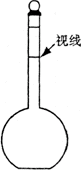
(3)某同学观察液面的情况如图所示,对所配溶液浓度有何影响?会_________(填
“偏高”、“偏低”或“无影响”)。
(4)若出现如下情况,所配溶液浓度将偏高还是偏低?没有进行操作步骤④,会______;
加蒸馏水时不慎超过了刻度,会_________。
(5)若实验过程中出现如下情况应如何处理?加蒸馏水时不慎超过了刻度,应___________;
向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面,应_____________。
[答案]
五、(本题包括 4小题,共24分)
21、(8分)(1)等质量的O2和O3,它们的物质的量之比为________,所含分子数之比为________,所含原子数之比为___________,相同状况下的体积之比为___________,相同状况下的密度之比为___________。
(2)同温同压下,等体积的O2和O3的质量之比为__________,分子数之比为___________,原子数之比为___________。
[答案]
22、(4分)某盐饱和溶液的浓度为26.8%,取一定量的此饱和溶液,加入Wg无水盐,在温度不变的情况下,析出mg含有一定量结晶水的该盐晶体,则从饱和溶液中析出溶质的质量为____________。
[答案]
23、(6分)将4mL O2和3mL NxHy(y≥x)的混合气体在120℃、1.01×105Pa下点燃,完全反应后,恢复到原温度和压强时,测得反应后N2、O2、H2O(g)混合气体密度减小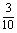 。 。
(1)NxHy燃烧反应的化学方程式是____________。
(2)推算NxHy的化学式的计算依据是(用文字叙述)______________,并写出x与y之间的关系式(用含x、y的代数式表示)__________,当x=_____时,符合题意,所以NxHy的化学式
为____________。
[答案]
24、(6分)已知某温度时饱和NaOH溶液中溶质的质量分数为A%,该饱和溶液的密度为ag·cm-3。
(1)该温度下NaOH的溶解度为____________。
(2)在500mL上述溶液中含有NaOH的质量为____________。
(3)上述饱和溶液中NaOH的物质的量浓度为____________。
(4)在100mL水中溶解NaOH至质量分数为A%时,溶液的体积是______。
[答案]
六、(本题包括 2小题,共11分)
25、(6分)在20℃时,将3.16g KNO3溶于10.0g水中,恰好配成密度为1.13g·cm-3的饱和溶液,计算:
(1)此饱和溶液中KNO3的质量分数。
(2)此饱和溶液中KNO3的物质的量浓度。
[答案]
26、(5分)已知钾的氧化物有K2O2和KO2,在两种化合物组成的混合物中,钾与氧的质量比为13:8,求混合物中K2O2与KO2的物质的量之比。
[答案]
- 返回 -
|

