|
一、选择题 (本题包括 18 小题,每小题 3 分,共 54 分。每小题有一个或两个选项符合题意)
1 、下列元素中,最高正化合价数值最大的是( )
A. C B. S
C. F D. Ne
2 、下列化合物中,阳离子半径与阴离子半径比值最小的( )
A. NaF B. NaCl
C. MgI2 D. KBr
3 、物质的量相同的 Mg2+、 F-、 H2O 三种粒子,一定含有相同的( )
A.电子数 B.质子数
C.中子数 D.质量数
4 、某元素 R 的最高价含氧酸的化学式为 HnRO2n-2 ,则在气态氢化物中, R 的化合价为( )
A. 3n-10 B. 3n-6
C. 3n-12 D. 2n-4
5 、下列化合物中,既含有极性键又含有非极性键的是( )
A. Na2O2 B. NH4Cl
C. CH4 D. H2O2
6 、医学研究证明,用放射性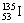 治疗肿瘤可收到一定疗效,下有有关 治疗肿瘤可收到一定疗效,下有有关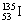 的叙述正确的是( ) 的叙述正确的是( )
A.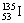 是碘的一种同素异形体 是碘的一种同素异形体
B.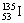 是一种新发现的元素 是一种新发现的元素
C.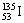 核内的中子数与核外电子数之差为 29 核内的中子数与核外电子数之差为 29
D.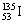 位于元素周期表中第 4 周期Ⅶ A 族 位于元素周期表中第 4 周期Ⅶ A 族
7 、硼有两种天然同位素,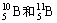 ,硼元素的相对原子质量为 10.81 ,则对硼元素中 ,硼元素的相对原子质量为 10.81 ,则对硼元素中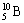 所占的百分比的判断正确的是( ) 所占的百分比的判断正确的是( )
A. 20% B.大于 20%
C.小于 20% D. 80%
8 、元素周期表中第 m 号元素,其原子的质量数为 n ,关于该元素的下列叙述中正确的是( )
A.其原子核内中子数和质子数都是 m
B.其原子核内中子数为(n-m)个,核外电子数肯定为 m 个
C.其原子质量为 12C 原子质量的 n 倍
D.其原子质量与 12C 原子质量之比约为 n:12
9 、下列关于氧化物的叙述中正确的是( )
A.所有的碱性氧化物都是金属氧化物
B.所有的金属氧化物都是碱性氧化物
C.不能和酸反应的氧化物一定能和碱反应
D.所有的非金属氧化物都是酸性氧化物
10 、某电子层当它作为最外层时,最多只能容纳 8 个电子,当它作为次外层时,最多只能容纳 18 个电子,该电子层可能是( )
A.M 层 B.K 层
C.L 层 D.P 层
11、A、B 为同主族的两元素, A 在 B 的上一周期,若 A 的原子序数为 n ,则 B 的原子序数不可能为( )
A.n+8 B.n+18
C.n+32 D.n+20
12 、下列各元素的氧化物中,既能与盐酸反应生成盐和水,又能与 NaOH 溶液反应生成盐和水的是( )
A.元素 X :它的原子中 M 层比 L 层少 2 个电子
B.元素 Z :位于元素周期表中的第 3 周期Ⅲ A 族
C.元素 Y :它的 2 价阳离子核外电子总数与氩原子相同
D.元素 W :它的焰色反应颜色呈紫色
13、a、b、c、d、e 是同周期的五种主族元素, a 和 b 的最高价氧化物的水化物显碱性,且碱性 b>a , c 和 d 的气态氢化物的还原性 d>c , e 为金属元素。五种元素的原子,得失电子后所形成的简单离子中, e 的离子半径最小,则它们的原子序数由小到大的顺序是( )
A. b、a、e、d、c B. e、d、a、b、c
C. a、b、d、c、e D. c、d、e、a、b
14 、元素周期表的第 7 周期称为不完全周期,若将来发现的元素把第 7 周期全排满,则下列推论错误的可能性最大的是( )
A.该周期的元素都是放射性元素
B.该周期的元素,原子序数最大为 118
C.该周期的元素Ⅶ A 族元素是金属元素
D.该周期的Ⅲ A 族元素的氢氧化物具有两性
15、A、B 都是短周期元素,原子半径 B>A ,它们可形成化合物 AB2 ,由此可以得出的正确判断是( )
A.原子序数: A<B B. A 和 B 可能在同一主族
C. A 可能在第2周期ⅣA族 D. A 肯定是金属元素
16 、已知 X+、 Y2+、 Z-、 W2-四种离子均具有相同的电子层结构。下列关于 X、Y、Z、W 四种元素的描述,正确的是( )
A.原子半径: X>Y>Z>W
B.原子序数: Y>X>Z>W
C.原子最外层电子数: Y>X>Z>W
D.金属性: X>Y ,还原性: W<Z
17 、已知 A、B 分别为同周期的Ⅰ A 和Ⅶ A 族的两种元素,它们的原子序数 分别为 m 和 n ,则下列关系不可能成立的是( )
A. n=m+16 B. n=m+6
C. n=m+30 D. n=m+10
18 、有物质的量相等的短周期金属元素单质 A 和 B ,在 A 中加入足量盐酸,在 B 中加入足量稀硫酸,反应完全后,生成氢气的体积分别为 V1 和 V2 ,且 V1 ≠ V2 ,若要确定生成物中 A 和 B 的化合价,至少还需要的数据是( )
A. V1:V2 B. V1 和 V2 的值
C. A 和 B 的物质的量 D.盐酸和稀硫酸的物质的量浓度
[提示]
二、填空题 (本题包括 6 小题,共 33 分)
19、( 5 分)用①质子数、②中子数、③核外电子数、④最外层电子数、⑤电子层数填写下列空格(填写编号):
(1)原子种类由 _________ 决定。
(2)元素种类由 _________ 决定。
(3)元素有同位素由 _________ 决定。
(4)同位素相对原子质量由 _________ 决定。
(5)元素的原子半径由 _________ 决定。
(6)核电荷数由 _________ 决定。
(7)元素的化合价主要由 _________ 决定。
(8)价电子数通常是指 _________ 。
(9)元素的化学性质主要由 _________ 决定。
20、(8 分)在原子序数为 1 ~ 18 的元素(除稀有气体元素)及其对应的单质和化合物中,选择符合下列各题条件者,将其名称或化学式填入空格内。
(1)原子半径最小的元素是 _________ ,最大的元素是 _________ 。
(2)地壳中含量最多的非金属元素是 ______ ,含量最多的金属元素是 _______ 。
(3)常温下有颜色的气体单质是 _________ 。
(4)最高价氧化物对应水化物酸性最强的化合物是 _________ ,碱性最强的化合物是 _________ ,呈两性的化合物是 _________ 。写出在水溶液中三者之间相互反应的离子方程式:_________________________ 。
[答案]
21、(3 分)有下列五种物质:①干冰、②甲烷、③过氧化钠、④氯化铵、⑤氢氧化钠,用数字编号回答下列各小题。
(1)含有非极性键的离子化合物是 _________ 。
(2)以极性共价键结合形成的共价化合物是 _________ 。
(3)含有极性共价键和离子键的化合物是 _________ 。
22、(5 分) A、B 两种元素, A 的原子序数为 x , A 和 B 所在周期包含元素种类分别为 m 和 n 。
(1)如果 A 和 B 同在ⅠA 族,当 B 在 A 的上一周期时, B 的原子序数是 _______(用x、m、n表示,下同),当B在A的下一周期,B的原子序数是 _______ 。
(2)如果 A 和 B 同在Ⅶ A 族,当 B 在 A 的上一周期时, B 的原子序数是 _______ ,当 B 在 A 的下一周期, B 的原子序数是 _______ 。
(3)若 A 的氯化物的化学式为 ACly ,分子中各原子最外层电子数之和为 26 , y 的值为 _________ 。
23、(6 分)(1) X、Y 两种主族元素能形成 XY2 型化合物,已知 XY2 中共有 38 个电子,若 XY2 为常见元素形成的离子化合物时,其电子式为 _________ ,若 XY2 为共价化合物时,用电子式表示该化合物的形成过程 __________________ 。
(2)若 K37ClO3+6H35Cl=KCl+3Cl2↑+3H2O ,则此反应中生成氯气的平均相对分子质量约为(计算结果保留三位有效数字) _______。
[答案]
24、(6 分)短周期元素在周期表中的位置如下图所示。
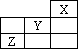
(1) X 元素的单质分子式是 _________ ,若 X 的原子核内中子数、质子数相等, X 单质的摩尔质量是 _________ 。
(2) Z 与钠的化合物属于 _________ (填“共价化合物”“离子化合物”),其电子式为_________ 。
(3) 1 mol Y 的单质与足量水反应,氧化剂是 _______ ,发生电子转移为 _______mol 。
[答案] 三、计算题(本题包括 2 小题,共 13 分)
25、(6 分)某核素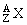 的氯化物 XCl2 1.11g 配成溶液后,需用 1mol /L 的硝酸银溶液 20mL 才能把氯离子完全沉淀下来,试计算: 的氯化物 XCl2 1.11g 配成溶液后,需用 1mol /L 的硝酸银溶液 20mL 才能把氯离子完全沉淀下来,试计算:
(1) X 的质量数。
(2) 若 X 的核内中子数为 20 ,求 37gXCl2 中所含质子的物质的量是多少?
[答案]
26、(7 分)有相对原子质量均大于 10 的 A、B 、两种元素,能形成两种化合物 X 和 Y ,已知等物质的量的 X 和 Y 形成混合物的密度为相同条件下 H2密度的 18.5 倍,其中 X 和 Y 的质量比为 15:22 ,经测试, X 的组成为 AB , Y 的组成为 AnB ,通过计算确定 A、B 两元素名称。(已知 A、B 的质子数与中子数分别相等)
[答案] - 返回 -
|