|
相对原子质量: H—1 C—12 O—16 Na—23 Cl—35.5 K—39
第I卷(选择题,共49分)
一、选择题 (本题包括 5小题,每小题2分,共10分,每小题只有一个选项符合题意)
1、金属钠着火时,能用来灭火的是( )
A.水 B.湿抹布
C.干沙 D.泡沫灭火器
2、钠应用在电光源上,可制造高压钠灯是因为( )
A.钠是活泼金属 B.钠燃烧时产生黄色火焰
C.钠是电的良导体 D.钠发出的黄光射程远,透雾力强
3、下列关于钠的说法中正确的是( )
A.钠比铜活泼,钠可把CuCl2溶液中的铜置换出来
B.金属钠是一种暗灰色金属
C.金属钠易被还原,所以保存在煤油里
D.钠跟水反应时钠浮在水面上,说明钠比水轻
4、将NaHCO3装入试管中加热,使产生的气体依次通过盛有Na2O2、澄清石灰水、浓H2SO4的容器,最后得到的气体是( )
A.H2O B.CO
C.O2 D.CO2和O2
5、Na与下列物质反应产物是唯一的是( )
A.HCl B.H2O
C.O2 D.Cl2
[提示] 二、选择题 (本题包括 8小题,每小题3分,共24分,每小题有一个或两个选项符合题意)
6、下列离子方程式正确的是( )
A.钠投入到水中Na+H2O=Na++OH-+H2↑
B.钠投入到硫酸铜的溶液中2Na+Cu2+=2Na++Cu
C.钠投入到盐酸中2Na+2H+=2Na++H2↑
D.氢氧化钠溶液与碳酸氢钠溶液反应OH-+H+=H2O
7、下列关于Na的说法中,哪种是错误的( )
A.钠的化合物通常都是固态,并能形成无色溶液
B.钠的原子有强还原性,钠离子有弱氧化性
C.电解熔融的氯化钠过程中,钠离子被氧化成钠原子
D.金属钠很软,是热的良导体,比水轻、熔点低于100℃
8、氢化钠(NaH)是白色离子晶体,其中钠为+1价,NaH与水反应放出氢气,下列叙述中正确的是 ( )
A.NaH在水中显酸性
B.NaH中氢离子的电子层排布与氦原子相同
C.NaH中氢离子可被还原成氢气
D.在NaH中氢元素只有氧化性,钠元素只有还原性
9、①钾比水轻;②钾的熔点较低;③钾与水反应时要放出热量;④钾与水反应后溶液呈碱性,某学生将一小块金属钾投入滴有酚酞试液的水中,以上实验能证明上述四点性质中的( )
A.①④ B.①②④
C.①③④ D.①②③④
10、已知钡的活动性处于钾和钠之间,则下述说法中可能实现的是( )
A.钡可以从KCl溶液中置换出钾
B.钡可以从冷水中置换出氢气
C.钡可以NaCl溶液中置换出钠
D.在溶液中钡离子可氧化金属锌
11、Na2O2和过量NaHCO3在密闭容器中混合充分加热后,最终残留固体是( )
A.Na2O和Na2O2 B.Na2O2和Na2CO3
C.Na2CO3 D.NaOH
12、下列物质中既可以与盐酸反应,又能与烧碱溶液反应的化合物是( )
A.Na2CO3溶液 B.NaHCO3溶液
C.Na D.CO2
13、钠在干燥空气中形成的氧化物0.7g溶于水后,可被含溶质为0.73g的盐酸恰好中和,钠的氧化物的成分是( )
A.Na2O B.Na2O和Na2O2
C.Na2O2 D.Na2O和NaO2
[提示] 三、选择题 (本题包括 5小题,每小题3分,共15分,每小题只有一个选项符合题意。
14、某混合物经测定只含钠和氧两种元素,将其放入足量的水中可产生两种气体,则该混合物的组成是( )
A.只有两种物质 B.只有三种物质
C.两种或两种以上的物质 D.无法确定
15、向各盛有1L水的A、B、C、D四个烧杯中分别加入23g Na、62g Na2O、78g Na2O2、40g NaOH,固体完全溶解后,各杯溶液中溶质的质量分数的顺序是( )
A.D>C>B>A B.B=C>A>D
C.B=C>A=D D.B>C>A>D
16、某碱金属R的单质mg,与3.55g Cl2恰好反应,生成(m+3.55)g氧化物,将mgR与O2反应,生成化合物质量可能是( )
A.(m+6.4)g B.(m+1.8)g
C.(m+1.6)g D.(m+2.4)g
17、估计下列溶液中溶质质量分数最大的是( )
A.4.6g Na投入45.4g 水中 B.6.2g Na2O投入43.8g水中
C.7.8g Na2O2投入42.2g 水中 D.8g NaOH投入42g水中
18、有甲、乙、丙三份等体积等浓度的NaOH溶液,在甲中加水稀释1倍,在乙中通入过量的CO2,将丙浓缩1倍,然后分别加等浓度的H2SO4溶液,当溶液呈中性时,加入H2SO4溶液的体积是( )
A.甲=乙=丙 B.甲=乙>丙
C.甲>乙>丙 D.乙>甲>丙
[提示]
第Ⅱ卷(非选择题,共 51分)
四、 本题包括 2小题,共15分。
19、(6分)现有NaHCO3和Na2CO3·xH2O的混合物,为了测定x值,某同学采用如下图装置进行实验:(碱石灰为NaOH和CaO的混合物)。
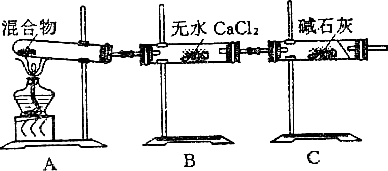
(1)A装置的作用是______________________
(2)B装置的作用是______________________
(3)C装置的作用是______________________
(4)若A试管中装有混合物3.7g,用酒精灯加热到不再产生气体,此时B管增重1.89g,C管增重0.22g,则x值为________________。
20、(9分)工业生产的纯碱中常含有少量的NaCl等杂质。下图是测定产品中Na2CO3质量分数的实验装置。实验操作步骤有:
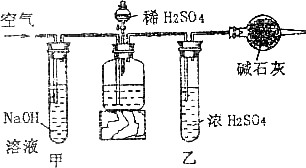
A、在干燥管内填满碱石灰,质量为mg;
B、取ng样品装入广口瓶中;
C、检验装置的气密性;
D、缓缓鼓入空气数分钟,再称干燥管质量为wg;
E、缓慢加入稀硫酸至不再产生气体为止。
(1)正确的操作顺序是(填写符号):C→_________→B_________→D
(2)操作步骤D中,要缓缓鼓入空气数分钟,鼓入空气的作用是_______;装置甲的作用是__________;装置乙的作用是__________。
(3)计算溶液中的Na2CO3质量分数的计算式为___________。
(4)若去掉装置甲,测定结果会_________;若去掉装置乙,测定结果会__________(填“偏大”,“偏小”或“无影响”)。
[答案]
五、 (本题包括 2小题,共11分)
21、(7分)下图中,A是单质,B的焰色反应为黄色。判断A、B、C、D的化学式:
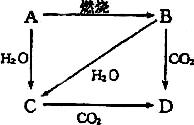
A、__________ B、__________ C、__________ D、__________
写出下列转化的化学方程式:
① A→B____________________________。
② B→D____________________________。
③ A→C____________________________。
22、(4分)写出下列反应的化学方程式,是离子反应的只写出离子方程式:
①钠在空气中燃烧: _____________________________________。
②钠投入水中: _________________________________________。
③钠投入CuSO4溶液中:__________________________________。
④钠投入稀H2SO4中:____________________________________。
[答案]
六、 (本题包括 2小题,共12分)
23、(6分)澄清石灰水中不断通入二氧化碳直至过量时,溶液先变混浊,再变澄清,有关离子方程式为______________________,若在碳酸钠饱和溶液中不断通入二氧化碳,将有晶体析出,该晶体是___________,反应的化学方程式为_________________________________。
析出晶体的原因是:
① ______________________________________;
② ______________________________________;
③ ______________________________________。
24、(6分)称取一定量的纯碱,溶于水后,与盐酸完全反应放出CO2,用“增多”或“减少”填空:
(1)若纯碱中含NaCl,则所需盐酸用量________产生气体_________。
(2)若纯碱中含K2CO3,则所需盐酸用量________产生气体_________。
(3)若纯碱中含NaHCO3,则所需盐酸用量________产生气体________。
[答案]
七、 (本题包括 2小题,共13分)
25、(6分)一块表面已部分被氧化成氧化钠的钠块质量为1.08g,投入到100g水中,完全反应后收集到0.02g H2。求:
(1)未被氧化的金属钠的质量是多少?
(2)被氧化的金属钠的质量是多少?
26、(7分)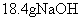 和 和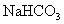 固体混合物,在密闭容器中加热到约250℃,经充分反应后排出气体,冷却后称得剩余固体质量为 固体混合物,在密闭容器中加热到约250℃,经充分反应后排出气体,冷却后称得剩余固体质量为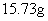 。试计算原混合物中 。试计算原混合物中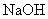 的质量分数。 的质量分数。
[答案]
- 返回 -
|



