本周学习第六章《氧族元素 环境保护》第一节《氧族元素》,内容包括:
1、氧族元素
从原子的核电荷数、原子结构示意图、原子半径、最外层电子所受作用力的大小、非金属性和金属性等几个方面来讨论氧、硫、硒、碲的结构和性质的变化,从而理解它们性质的相似点和不同点。
2、硫
硫的物理性质和化学性质。
3、O3
同素异形体,O3的分子结构、物理性质、化学性质、产生和应用。
注意:
(1)它们能形成H2R型气态氢化物(Te不能与H2直接化合),它们的水溶液均呈酸性(H2O除外)。
(2)它们都能和氧结合生成RO2和RO3型氧化物(O除外),这些氧化物均是酸酐,其对应的水化物分别为H2RO3和H2RO4型两种酸。
(3)从原子结构有关知识理解元素金属性、非金属性的递变规律。
从O到Te:核电荷数逐渐增多 原子的电子层数逐渐增多
原子的电子层数逐渐增多 原子半径逐渐增大
原子半径逐渐增大 原子核对最外层电子的吸引力逐渐减弱
原子核对最外层电子的吸引力逐渐减弱 原子得到电子的能力逐渐减弱,失去电子的能力逐渐增强
原子得到电子的能力逐渐减弱,失去电子的能力逐渐增强 元素的金属性逐渐增强、非金属性逐渐减弱。
元素的金属性逐渐增强、非金属性逐渐减弱。
(4)氧族元素和卤族元素比较
相似点:
①都能与金属、H2直接化合(Te及At、Po除外);
②气态氢化物的水溶液均呈酸性(O除外);
③氧化物均为酸酐(O、F除外),最高价氧化物对应水化物的酸性随核电荷数的增大而逐渐减弱。
不同点:
①与金属、H2化合时,卤族元素显-1价,氧族元素显-2价;
②同周期的氧族元素、卤族元素的单质,前者与H2化合更难,前者生成气态氢化物的水溶液均为弱酸(H2O除外),后者除HF外其余氢化物的水溶液均为强酸;
③同周期氧族元素比相应卤素的非金属性弱。
(二)硫
1、物理性质
常温下是一种淡黄色的晶体,俗称硫磺,熔、沸点较低,不溶于水,微溶于酒精,易溶于CS2,自然界中,游离态的硫可存在于火山喷口附近。
2、化学性质
氧化性:Fe+S FeS(硫化亚铁)
FeS(硫化亚铁)
2Cu+S Cu2S(硫化亚铜)
Cu2S(硫化亚铜)
Hg+S=HgS(消除汞毒)
H2+S H2S
H2S
还原性:S+O2 SO2
SO2
3S+6NaOH 2Na2S+Na2SO3+3H2O
2Na2S+Na2SO3+3H2O
(S既表现氧化性又表现还原性)
(三)臭氧
1、同素异形体
(1)定义:由同种元素形成的几种性质不同的单质。
例如:碳元素的同素异形体——金刚石、石墨
氧元素的同素异形体——氧气和臭氧
磷元素的同素异形体——红磷和白磷
硫元素的同素异形体——菱形硫和单斜硫
(2)注意事项
同素异形体的化学性质相似,而物理性质不同;
同位素研究的对象是微观的原子,而同素异形体研究的对象是宏观的单质。
2、臭氧的物理性质
O3是等腰三角形空间结构的由非极性键形成的极性分子。
3、臭氧的物理性质
(1)常温、常压下,O3是一种有特殊臭味的淡蓝色气体;
(2)密度比O2大,比O2易溶于水;
(3)液态O3呈深蓝色,沸点的-112.4℃;
固态O3呈紫黑色,熔点为-251℃。
4、臭氧的化学性质
(1)不稳定性
2O3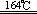 3O2
3O2
注:常温下分解较慢,在受热、光照和MnO2等作用下迅速分解。
(2)强的氧化性
就氧化能力而言,它介于氧原子和氧分子之间。
2Ag+2O3=Ag2O2+2O2
O3+2KI+H2O=2KOH+I2+O2
注:臭氧能使湿润的KI淀粉试纸变蓝,利用此性质可测定微量O3的含量,也可检验O3。
5、臭氧的产生、应用及臭氧层的保护
(1)产生:3O2 2O3
2O3
(2)应用:能吸收紫外线,并且是一种很好的漂白剂和消毒剂。
6、同素异形体与同位素
|
同素异形体 |
同位素 |
定义 |
由同一种元素形成的几种性质不同的单质 |
同一元素的不同核素之间互称为同位素 |
研究对象 |
单质;物理性质差别大,化学性质稍有差别 |
原子;化学性质基本相同 |
常见实例 |
O2和O3;金刚石和石墨 |
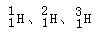
|
7、臭氧与氧气性质对比
|
O3 |
O2 |
状 态 |
有特殊臭味淡蓝色气体 |
无色无味气体 |
液 态 |
深蓝色 |
淡蓝色 |
固 态 |
紫黑色 |
雪花状,淡蓝色 |
沸 点 |
-112.4℃ |
-183℃ |
熔 点 |
-251℃ |
-218℃ |
化学性质
|
臭氧比氧气更活泼
2O3 3O2 3O2 3O2 3O2 2O3 2O3 |