1、不同物质间的氧化还原反应
(1)全部氧化还原反应(变价元素的所有原子的价态发生变化)

(2)部分氧化还原反应(变价元素的原子只有部分价态发生变化)
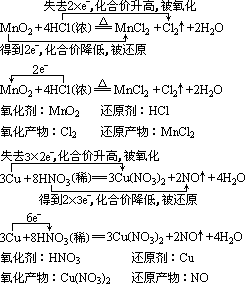
2、同一物质内不同元素间的氧化还原反应

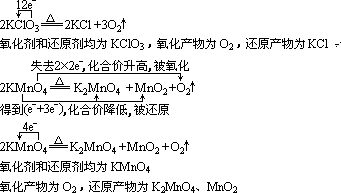
3、两种以上元素间的氧化还原反应
(1)一种元素氧化两种元素
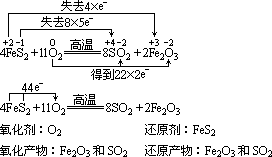
(2)一种元素还原两种元素
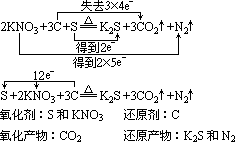
4、同种元素间的氧化还原反应
(1)歧化反应:同一物质中同种价态的同一元素的化合价部分升高、部分降低的反应。
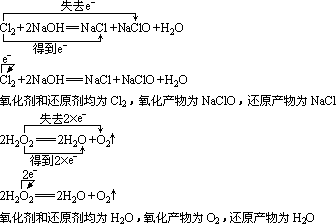
(2)归中反应:不同价态的同一元素都转化为同一化合价该元素的反应。
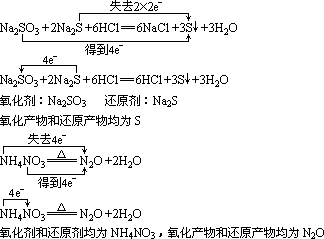
(3)其它反应

(二)氧化性和还原性强弱的判断方法
1、根据金属活动性顺序进行判断

2、根据反应方程式进行判断
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
3、根据被氧化或被还原的程度不同进行判断
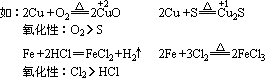
4、根据反应条件判断
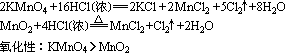
(三)常见的氧化剂和还原剂
常见的氧化剂有: Cl2、O2、S、Fe3+、Cu2+、MnO2、KMnO4、K2Cr2O7、浓H2SO4、HNO3等。
常见的还原剂有: K、Na、Mg、Fe、Fe2+、Cl-、S2-、C、H2、SO2等。
(四)氧化还原反应的规律
1、守恒律
化合价有升必有降,电子有得必有失。对于一个完整的氧化还原反应,化合价升高总数与降低总数相等,失电子总数与得电子总数相等。
2、价态律
元素处于最高价,只有氧化性;元素处于最低价,只有还原性;元素处于中间价态,既有氧化性又有还原性,但主要呈现一种性质。物质若含有多种元素,其性质是这些元素性质的综合体现。如 HCl,既有氧化性(由氢元素表现出的性质),又有还原性(由氯元素表现出的性质)。
3、强弱律
较强氧化性的氧化剂跟较强还原性的还原剂反应,生成弱还原性的还原产物和弱氧化性的氧化产物。

4、转化律
氧化还原反应中,以元素相邻价态间的转化最容易;同种元素不同价态之间若发生反应,元素的化合价只靠近不交叉;同种元素相邻价态间不发生氧化还原反应。

5、难易律
越易失电子的物质,失后就越难得电子,越易得电子的物质,得后就越难失去电子。
一种氧化剂同时和几种还原剂相遇时,还原性最强的先发生反应;一种还原剂遇多种氧化剂时,氧化性最强的先发生反应。
例1、已知反应:2FeCl3+2KI=2FeCl2+2KCl+I2①
2FeCl2+Cl2=2FeCl3 ②
I2+SO2+2H2O=H2SO4+2HI ③
判断下列物质的还原能力由大到小的顺序是
A.I->Fe2+>Cl->SO2 B.Cl->Fe2+>SO2>I-
C.Fe2+>I->Cl->SO2 D.SO2>I-> Fe2+> Cl-
答案:D
解析:(1)根据氧化还原反应的规律:
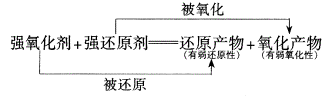
氧化剂得电子的还原产物,具有一定还原性,但其还原性小于反应物中的还原剂。由此可知,根据反应方程式可以判断还原能力强弱:由反应①可知:I->Fe2+,反应②可知:Fe2+>I-,反应③可知:SO2>I-,三者的关系为SO2>I-> Fe2+> Cl-。
例2、氧化还原反应的特征是反应前后元素的化合价发生改变。根据这一特征判断下列反应属于氧化还原反应的是( )
A.2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3
B.K2MnO4+Cl2=2KCl+MnO2+O2
C.K2MnO4+Cl2=2KCl+2Mn2O7
D.6NaAlO2+Al2(SO4)3+12H2O=8Al(OH)3↓+3Na2SO4
答案:B、C
解析:由化学反应前后元素化合价的变化来判断可知A、D两个反应方程式,反应前后元素的化合价均没有发生变化。B选项中化学反应方程式中Mn元素由+6价变为+4价,氧元素由-2价变为0价,Cl元素由0价变为-1价;C选项中Cl元素由+5价下降至-1价,Mn元素由+6价上升至+7价。