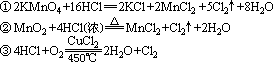|
第I卷(选择题,共49分)
一、选择题(本题包括 5小题,每小题2分,共10分。每小题只有一个选项符合题意)
1、 CaH2常作生氢剂,其中氢元素呈-1价,其化学方程式为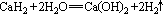 ,其中水是( ) ,其中水是( )
A.还原剂 B.氧化剂
C.既是还原剂又是氧化剂 D.既不是氧化剂又不是还原剂
2、化学变化中不能实现的是( )
A.一种原子变成另一种原子 B.一种分子变成另一种分子
C.一种离子变成另一种离子 D.一种单质变成另一种单质
3、物质在空气中燃烧、自燃、缓慢氧化,三者的共同点是( )
①都产生热量 ②都发光
③都是氧化还原反应 ④都要点燃
A.①② B.①③
C.③④ D.①②③④
4、下列两个化学反应:
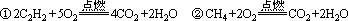
它们的共同点是( )
A.属于置换反应 B.属于分解反应
C.属于化合反应 D.属于氧化还原反应
5、下列哪个反应表示二氧化硫被还原( )
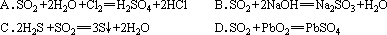
二、选择题(本题包括 8小题,每小题3分,共24分。每小题有一个或两个选项符合题意)
6、从矿物学资料查得,一定条件下自然界存在如下反应:
14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,下列说法正确的是( )
A.Cu2S既是氧化产物又是还原产物
B.5 molFeS2发生反应,有10 mol电子转移
C.产物中的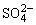 离子有一部分是氧化产物 离子有一部分是氧化产物
D.FeS2只作还原剂
7、下列反应中属于氧化还原反应,但水既不作氧化剂又不作还原剂的是( )

8、下列叙述中,正确的是( )
A.含氧酸能起氧化作用,无氧酸则不能
B.阳离子只有氧化性,阴离子只有还原性
C.失电子难的原子获得电子的能力一定强
D.由X变为X2+的化学反应是氧化反应
9、下列叙述中,不正确的是( )
A.含有非金属元素的离子一定都是阴离子
B.化合反应不一定都属于非氧化还原反应
C.复分解反应一定都属于非氧化还原反应
D.有单质生成的反应一定是氧化还原反应
10、在下列物质间相互变化中,需要加入氧化剂才能实现的是( )
A.H2SO4→MgSO4 B.HCl→Cl2
C.CuSO4→Cu D.HClO→Cl2
11、下列说法中错误的是( )
A.得电子的反应物是氧化剂
B.在化学反应中某元素化合价升高,即被氧化
C.氧化剂被还原后,所得到的生成物称氧化产物
D.还原剂在氧化过程后,元素的化合价升高
12、下列叙述中正确的是( )
A.含最高价元素的化合物,一定具有强氧化性
B.得电子越多的氧化剂,氧化性越强
C.失电子越多的还原剂,还原性越强
D.强氧化剂与强还原剂不一定能发生氧化还原反应
13、下列说法不正确的是( )
A.H+的氧化性比Cu2+强
B.H2O既可作氧化剂,又可作还原剂
C.HCl既有氧化性又有还原性
D.Fe只能作还原剂
三、选择题(本题包括 5小题,每小题3分,共15分。每小题只有一个选项符合题意)
14、在3Cl2+8NH3=6NH4Cl+N2反应中,还原性最强的物质是( )
A.Cl2 B.NH3
C.NH4Cl D.N2
15、已知反应:2FeCl3+2KI=2FeCl2+2KCl+I2 ①
2FeCl2+Cl2=2FeCl3 ②
I2+SO2+2H2O=H2SO4+2HI ③
判断下列物质的还原能力由大到小的顺序是( )
A.I->Fe2+>Cl->SO2 B.Cl->Fe2+>SO2>I-
C.Fe2+>I->Cl->SO2 D.SO2>I-> Fe2+> Cl-
16、 在反应3S+6KOH=K2SO3+2K2S+3H2O中,氧化剂与还原剂的质量之比为( )
A.1∶2 B.2∶1
C.1∶1 D.3∶2
17、下列反应中,盐酸作氧化剂的是( )
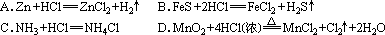
18、硫酸铵在强热条件下分解,生成NH3、SO2、N2和H2O,反应中生成的氧化产物和还原产物分子个数比为( )
A.1∶3 B.2∶3
C.1∶1 D.4∶3
[提示] 第Ⅱ卷(非选择题,共 51分)
四、(本题包括 2小题,共11分)
19、(3分)分析下列制Cl2的反应,判断氧化性强弱。
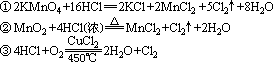
氧化性强弱的顺序为 ________________。
[答案与提示]
20、(8分)在反应2KMnO4+16HCl=2MnCl2+2KCl+5Cl2↑+8H2O中,
试从氧化还原与元素化合价的升降的角度分析上述反应,并回答下列问题:
(1)___________元素被氧化,________是氧化剂。
(2)___________是氧化产物,_______发生氧化反应。
(3)在参加反应的盐酸中,起还原剂(被氧化)作用的HCl与参加非氧化还原反应的HCl的质量比为__________。
[答案与提示] 五、(本题包括 4小题,共28分)
21、(6分)铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,具有很强的氧化性,反应如下:
Na2FeO4+NaNO3+NaCl+H2O→Fe(NO3)3+NaOH+Cl2↑
(1)反应中_______元素被氧化,转移电子总数为________。
(2)配平上述反应,标明电子转移的方向和数目。
(3)上述反应中氧化剂是_________,还原剂是________,氧化产物和还原产物的质量比为________。
[答案]
22、(8分)在反应 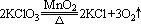 中,被氧化的元素是_______,被还原的元素是_______,氧化剂是________,还原剂是__________,氧化产物是_________,还原产物是__________,电子转移总数是_________。 中,被氧化的元素是_______,被还原的元素是_______,氧化剂是________,还原剂是__________,氧化产物是_________,还原产物是__________,电子转移总数是_________。
[答案]
23、(6分)在Fe、Fe2+、Fe3+、Cl2、Cl-、ClO4-、Na+几种微粒中,只有氧化性的是__________,只有还原性的是__________,既有氧化性又有还原性的是____________。
[答案]
24、(8分)智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘,其化学方程式为:2NaIO3+5NaHSO3=3NaHSO4+2Na2SO4+I2+H2O
(1)反应中________元素被氧化,_________是氧化剂。
(2)同双线桥表示法标出电子转移方向和总数。
(3)反应产物中,所得氧化产物和还原产物质量之比为_____________。
[答案]
六、(本题包括 2小题,共12分)
25、(6分)在反应2Na+Cl2=2NaCl中电子转移的总数是__________,当有7.1g氧化剂被还原时,有________g还原剂被氧化。
[答案与提示]
26、(6分)在反应3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O中当有64g铜被氧化时有多少克HNO3被还原?总共消耗硝酸多少克?生成NO多少克?
[解析] - 返回 -
|