1.阅读下列材料后,回答相应问题。
一个体重50kg的健康人,含铁2g,这2g铁在人体中不是以单质金属形式存在,而是以Fe2+和Fe3+的形式存在。二价铁离子易被吸收,给贫血者补充铁时,应给予含二价铁离子的二价铁盐,如硫酸亚铁(FeSO4)。服用维生素C,可使食物中的三价铁离子还原成二价铁离子,有利于铁的吸收。
(1)人体中经常进行 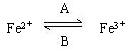 的转化,A中Fe2+做_________剂,B中Fe3+做_________剂。 的转化,A中Fe2+做_________剂,B中Fe3+做_________剂。
(2)“服用维生素C,可使食物中三价铁离子还原成二价铁离子。”这句话指出,维生素C在这一反应中做_________剂,具有_________性。
2.油画所用颜料含有某种白色铅的化合物,置于空气中,天长日久后就会变成黑色的PbS,从而使油画的色彩变暗。若用H2O2来“清洗”,则可将PbS转变为白色的PbSO4,从而使油画“复原”。
(1)上述“清洗”反应的化学方程式为________________________。
(2)在此反应中,H2O2作_____________剂,发生转移的电子数目为__________。
3.录像用的高性能磁粉,主要材料之一是由三种元素组成的化学式为CoxFe3-xO3+x的化合物。已知氧为-2价,钴(Co)和铁可能是呈现+2价或+3价,且上述化合物中,每种元素只有一种化合价。则x值为___________,铁的化合价为____________,钴的化合价为__________。
参考答案:
1.将氧化还原反应的概念与人体内Fe3+、Fe2+的相互转化关系结合,可考查学生用理论知识解决实际问题的能力水平。(1)还原;氧化(2)还原;还原。
2.利用题目所给条件完成反应的化学方程式:PbS+4H2O2=PbSO4+4H2O,分析元素化合价的变化,双氧水中氧元素的化合价为-1价,反应后为-2价,化合价降低,H2O2作氧化剂,电子转移的个数为8。
3.1;+3;+2。(提示:根据化合物中元素化合价的代数和为零进行计算。)
|