A 卷
开始测试
B 卷
二、综合题
11. 有X、Y、Z、W四种短周期元素,原子序数依次增大,其核电荷数总和为38,Y元素原子最外层电子数占核外电子总数的3/4;W元素原子最外层电子比同周期Z元素多5个电子;W和Y不属同一主族。
(1)写出元素符号:X________,Y________,Z________,W________。
(2)Z、W两元素最高价氧化物对应水化物反应的方程式是___________。
(3)把Z单质(片状)放入滴有酚酞的沸水中,观察到的现象是_________,反应的化学方程式_________。
[答案]
12. A、B、C、D四种短周期元素的原子序数依次增大。A、D同族;B、C同周期。A、B组成的化合物甲为气态,其中A、B原子个数比为4:1。常温下,由A、C组成的两种化合物乙和丙都是液态,乙中A、C原子个数比为1:1;丙中A、C原子个数比为2:1。由D和C组成的两种化合物丁和戊都是固态,丁中D、C原子个数之比为1:1,戊中D、C原子个数比是2:1。B元素的最高价氧化物跟丁能发生化学反应,生成物为两种,其中一种为C的单质。
(1)各物质的化学式分别为:甲________,乙________,丙________,丁________,戊________。
(2)B元素的最高价氧化物跟丁反应的化学方程式为________________。
[答案]
13.(北京)A、B、C、D为常见气态单质。已知:
① A和B可以在放电条件下发生化合反应,其产物还可与B化合生成红棕色气体;
② C分别与A、B反应生成的两种化合物分子中都含有10个电子;
③ C和D反应生成的化合物易溶于水,在其溶液中滴加AgNO3,溶液,生成白色沉淀。
请回答:
(1) C和D反应生成的化合物的电子式是____________。
(2)上述②中化合物的热稳定性_____________强于_____________。(填写化学式)。
(3) 将D通入B、C生成的化合物中,发生反应的化学方程式为____________。
(4) A、C、D所含元素可组成一种离子化合物,该化合物发生水解反应的离子方程式_____________________。
[答案]
14.(上海)
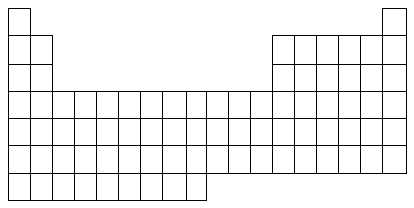
(1)在上面元素周期表中画出金属元素与非金属元素的分界线。
(2)根据NaH的存在,有人提议可把氢元素放在VIIA族,那么根据其最高正价与最低负价的绝对值相等,又可把氢元素放在周期表中的族。
(3)现有甲、乙两种元素,甲元素原子核外3p亚层上有5个电子,乙元素的焰色反应显黄色。
① 用元素符号将甲、乙两元素填写在上面元素周期表中对应位置。
② 甲元素与硫元素相比较,非金属性较强的是___________(填名称),写出可以验证该结论的一个化学反应方程式______________________。
[答案]
15.致冷剂是一种易被压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到致冷目的。人们曾采用过乙醚、NH3、CH3Cl等作致冷剂,但它们不是有毒,就是易燃。于是科学家根据元素性质的递变规律来开发新的致冷剂。
据现有知识,某些元素化合物的易燃性、毒性变化趋势如下:
(1)氢化物的易燃性:第二周期______>______>H2O、HF。
第三周期 SiH4>PH3>_______>_______。
(2)化合物的毒性:PH3>NH3;H2S_____H2O;CS2_____CO2;CCl4>CF4(选填>或<、=)。
于是科学家开始把注意力集中在含 F、Cl的化合物上。
(3)已知CCl4的沸点为76.8℃,CF4的沸点为-128℃,新的致冷剂的沸点范围应介于其间。经过较长时间反复试验,一种新的致冷剂氟里昂CF2Cl2终止诞生了,其他类似的还可以是_________。
(4)然而这种致冷剂造成了当今的某一环境问题是____________,但求助于周期表中元素及其化合物的____________变化趋势来开发致冷剂的科学思维方法是值得借鉴的。(填写字母)
①毒性 ②沸点 ③易燃性 ④水溶性 ⑤颜色
a.①②③ b.②④⑤ c.②③④
[答案]
|