原子(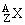 )
)
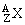 的含义:代表一个质量数为 A ,质子数为 Z 的原子。
的含义:代表一个质量数为 A ,质子数为 Z 的原子。
质量数(A)=质子数(Z)+中子数(N)
原子呈电中性:核电荷数=质子数=核外电子数
(二)、电子云
1、原子核外电子运动的特点
(1)电子的质量很小(约为9.1×10-31kJ),只有质子质量的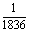 ;
;
(2)运动空间范围小,原子半径约为10-10m;
(3)运动速度极快,接近光速。
*2、测不定原理
电子在狭小空间里作高速运动与宏观物体运动不同,它是不能同时确定某一时刻的位置和速度。
3、电子云的概念
原子核外电子绕核高速运动没有确定轨道,就好像一团“带负电荷的云雾”笼罩在原子核周围,这种“带电荷的云雾”称为电子云。
说明:
(1)电子云是表示电子在空间出现机率大小的一种形象化的描述;
(2)电子云上的黑点不是代表一个电子,而是表示电子在原子核周围出现机会的多少,机率的大小;
(3)电子云中黑点稠密的地方,表明电子再现的机率大些,黑点稀疏的地方表明电子出现的机率小些。
(三)、原子核外电子排布
1、电子层的表示方法
2、原子核外电子分层排布的一般规律
在含有多个电子的原子里,电子依能量的不同分层排布,其规律是:
(1)核外电子总是尽先排布在能量较低的电子层,然后由里到外依次排布在能量逐步升高的电子层(能量最低原理)。
(2)原子核外各电子层最多容纳2n2个电子(n为电子层数)。
(3)原子最外层电子数目不能超过8(k为最外层不能超过2个电子)。
(4)次外层电子数目不能超过18个(k层为次外层时不能超过2个),倒数第三层电子数目不能超过32个。
3、结构示意图表示原子、离子结构
(1)原子:核电荷数=核外电子数 例: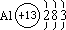
(2)阳离子:核电荷数>核外电子数 例: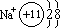
(3)阴离子:核电荷数<核外电子数 例: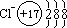
(四)、元素周期律
1、元素周期律
(1)定义:元素的性质随原子序数的递增而呈周期性变化的规律。
(2)内容:
①原子核外电子排布的周期性。
最外层电子数:从 1→8的周期性变化。
②原子半径的周期性变化
电子层数相同,从碱金属到卤素,随原子序数的递增,原子半径减小。
③元素主要化合价的周期性变化
正价:+ 1→+7 负价:-4→-1
(3)实质:元素性质随原子半径递增呈现出周期变化,其本质原因是元素的原子核外电子排布周期性变化的必然结果。
2、元素的金属性、非金属性的周期性变化
(1)元素金属性,非金属性强弱标志。
①元素金属性强弱的标志
a.与水或酸反应置换出氢气的难易:金属单质与水或酸(非氧化性酸)反应置换出氢气的速率越快(反应越剧烈)表示元素金属性越强。
b.最高价氧化物对应水化物的碱性强弱:碱性越强,表明元素金属性越强。
②元素非金属强弱标志
a.单质与氢气化合成气态氢化物难易及气态氢化物的稳定性:非金属单质与氢气化合越容易,形成气态氢化物越稳定,表明元素非金属性越强。
b.最高价氧化物对应水化物的酸性强弱:酸性越强,表明元素非金属性越强。
(2)以钠到氩为例,元素性质周期性变化