|
本试卷分第Ⅰ卷和第Ⅱ卷两部分。满分100分,考试时间90分钟。
可能用到的相对原子质量:H—1 C—12 N—14 O—16 Cl—35.5 Na —23 Mg—24
Al—27 S—32 Fe—56 Cu— 64
第Ⅰ卷(选择题,共49分)
一、选择题(本题包括5小题,每小题2分,共10分。每小题只有一个选项符合题意)
1、下列容器中,最不宜于制造储存浓H2SO4的容器是( )
A.铁 B.铝
C.铜 D.陶瓷
2、下列物质不能使品红溶液褪色的是( )
A.SO2 B.Cl2
C.O3 D.CO2
3、下列物质不属于“城市空气质量日报”报道的是( )
A.二氧化硫 B.氮氧化物
C.二氧化碳 D.悬浮颗粒
4、市场上销售的某消毒液,其商品标识上有如下叙述:①本产品为无色液体,呈碱性;②使用时,加水稀释;③可对餐具、衣服进行消毒,也可漂白浅色衣物。据此,可推断该产品的有效成份可能是( )
A.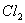 B. B.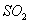
C.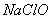 D. D.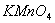
5、最近医学界通过用具有放射性的14C原子试验,发现C80的一种羧酸衍生物在特定条件下可通过断裂DNA杀死病毒,从而抑制艾滋病(AIDS)的传播。有关放射性的14C原子的叙述中正确的是( )
A.与12C原子的化学性质不同 B.与12C互为同位素
C.与14N的中子数相同 D.与C80互为同素异形体
二、选择题(本题包括8小题,每小题3分,共24分。每小题有一个或两个选项符合题意)
6、研究表明:H2O2具有立体结构,两个氢原子像在半展开书本的两页纸上,两页纸面的夹角约为94°,氧原子在书的夹缝上,O-H键与O-O健之间的空间夹角约为97°。下列说法不正确的是( )
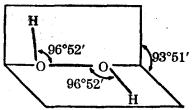
A.H2O2分子中既有极性健又有非极性健
B.H2O2分子是极性分子
C.H2O2与H2O互为同素异形体
D.H2O2既有氧化性又有还原性
7、下列物质中硫元素既能被氧化,又能被还原的是( )
A.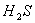 B.S B.S
C.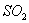 D. D.
8、工业上制取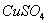 不是直接用铜与浓 不是直接用铜与浓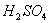 反应,而是将 反应,而是将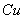 和少量的Ag的混合物浸在稀硫酸中并不断从容器下部吹入细小的空气泡,这样的优点是( ) 和少量的Ag的混合物浸在稀硫酸中并不断从容器下部吹入细小的空气泡,这样的优点是( )
①不产生污染大气的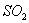 ②提高 ②提高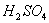 的利用率 ③节约能源,提高铜的利用率 的利用率 ③节约能源,提高铜的利用率
A.①② B.②③
C.①④ D.①②③
9、将含有a mol Na2SO3溶液跟含有b mol Na2S的溶液混合后无明显现象。若再加入稀H2SO4,则立即出现浅黄白色硫沉淀。有关叙述不正确的是( )
A.若a:b>1:2,生成S和SO2
B.若a:b=1:2,生成S而无SO2
C.若a:b<1:2,生成S和H2S
D.若a:b≤1:3,生成S、SO2、H2S
10、在烧瓶中将一卤化物与浓H2SO4的混合物共热制卤化氢气体,该卤化物是( )
A.CaF2 B.NaCl
C.KBr D.KI
11、为方便某些化学计算,有人将98%浓硫酸表示下列形式,其中合理的是( )
A.H2SO4·1/9H2O B.H2SO4·H2O
C.H2SO4·SO3 D.SO3·10/9H2O
12、有一瓶无色气体,可能含有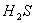 、 、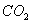 、 、 、 、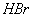 、 、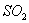 中的一种或几种,将其通入氯水中,得无色透明溶液,将这种溶液分为两份,向一份中加入用盐酸酸化的 中的一种或几种,将其通入氯水中,得无色透明溶液,将这种溶液分为两份,向一份中加入用盐酸酸化的 溶液,出现了白色沉淀;向另一份中加入用硝酸酸化的 溶液,出现了白色沉淀;向另一份中加入用硝酸酸化的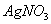 溶液,也产生了白色沉淀,与此有关的下列结论中,正确的是( ) 溶液,也产生了白色沉淀,与此有关的下列结论中,正确的是( )
A.肯定有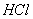 、 、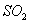 B.可能含有 B.可能含有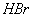 、 、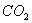
C.肯定没有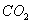 、 、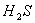 、 、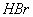 D.以上结论均不正确 D.以上结论均不正确
13、对下列事实解释错误的是( )
A.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B.浓硫酸和浓盐酸混合可制氯化氢,说明浓硫酸是一种难挥发的酸
C.常温下,浓硫酸可以用铝罐贮存,说明铝与浓硫酸不反应
D.反应CuSO4+H2S=CuS↓+H2SO4能进行,说明硫化铜既不溶于水,也不溶于稀硫酸
三、选择题(本题包括5小题,每小题3分,共15分。每小题只有一个选项符合题意)
14、某温度时CuSO4的溶解度是25g,若温度不变,将32g无水CuSO4粉末撒入m g水中,形成饱和溶液并有CuSO4·5H2O晶体析出时,m的取值范围是( )
A.18g≤m≤128g B.36g<m<180g
C.18g<m<128g D.36g≤m≤180g
15、常温时,向20L真空容器通入a mol硫化氢和b mol二氧化硫(a和b都是正整数,且a≤5,b≤5)反应完全后,容器内可能达到的最大密度约是( )
A.24.5g·L-1 B.14.4g·L-1
C.8g·L-1 D.5.1g·L-1
16、高温下硫酸亚铁发生如下反应:2FeSO4 Fe2O3+SO2↑+SO3↑,若将生成的气体通入氯化钡溶液中,得到的沉淀物是( ) Fe2O3+SO2↑+SO3↑,若将生成的气体通入氯化钡溶液中,得到的沉淀物是( )
A.BaSO3和BaSO4 B.BaS
C.BaSO3 D.BaSO4
17、在金属焊接和切割现场,常能闻到一股鱼腥臭味。经检测,那是电弧产生的臭氧的气味。臭氧具有很强的氧化性,可使湿润的碘化钾淀粉试纸变蓝色,有关反应的化学方程式为:O3+2KI+H2O=2KOH+I2+O2对此反应,下列说法正确的是( )
A.在此反应中O3是氧化剂,O2是还原产物
B.反应中有1molO3参加反应,转移电子为6mol
C.由此反应可知,氧化性强弱关系为:O3>I2>O2
D.被还原的氧原子与被氧化的I-的个数比为1:2
18、将SO2和Cl2按1:2体积比(同温同压)混合物,通入含有BaCl2和品红的混合溶液中,下列说法正确的是( )
A.溶液褪色,无沉淀生成
B.溶液褪色,有沉淀生成
C.溶液不褪色,无沉淀生成
D.溶液不褪色,有沉淀生成
第Ⅱ卷(非选择题,共51分)
四、填空题(本题包括4小题,共26分)
19、(6分)实验证明铜不能在低温下与O2反应,也不能与稀H2SO4共热发生反应,但工业上却是将废铜屑倒入热的稀H2SO4中并通入空气来制备CuSO4溶液的。铜屑在此状态下被溶解的化学方程式是_________________________。利用铜制备CuSO4的另一种方法,用化学方程式表示是_____________________________。
以上两种方法(前、后)_______者好,原因是_________________________。
20、(8分)下图虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物。填写下列空白。
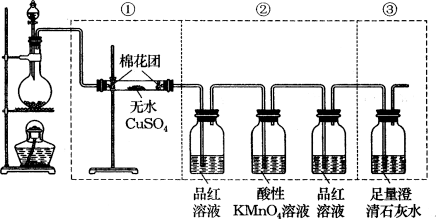
(1)如果将装置中①、②、③三部分仪器的连接顺序变为②、①、③,则可以检出的物质是_______,不能检出的物质是________。
(2)如果将仪器的连接顺序变为①、③、②,则可以检出的物质是_____,不能检出的物质是_________。
(3)如果将仪器的连接顺序变为②、③、①,则可以检出的物质是______,不能检出的物质是_________。
[答案] 五、综合题(本题包括4小题,共26分)
21、(9分)有a、b、c、d四种无色溶液,它们是Na2CO3、Na2SO4、NaHSO4、BaCl2中的某一种,为确定各是何种溶液进行了下面的实验,记录为:
①a+d→溶液+气体; ②b+c→溶液+沉淀; ③b+d→溶液+沉淀x;
④a+b→溶液y+沉淀; ⑤沉淀x+溶液y→溶液+气体。
(1)根据以上记录确定四种溶液中的溶质:
a_________;b_________;c_________;d_________。
(2)写出1—⑤各反应的离子方程式。
22、(6分)某亚硫酸钠已部分被氧化。为确定它的纯度,要进行如下实验:
①称取样品W1g;②将样品溶解;③给溶液加入稍过量盐酸酸化了的BaCl2溶液;④过滤、洗涤、干燥沉淀,称其质量为W2g。试回答:
(1)BaCl2要用盐酸酸化的原因是______________。
(2)BaCl2溶液要稍过量的原因是______________。
(3)判断操作③是否完成的方法是_____________。
(4)判断沉淀是否洗净的方法是_______________。
(5)Na2SO3纯度的表示式为___________________。
[答案]
23、(6分)汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的污染源,治理的方法之一是在汽车的排气管上装一个“催化剂转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化。
(1)写出CO与NO反应的化学方程式____________________。
(2)“催化剂转换器”的缺点是在一定程度上提高空气的酸度。其原因是_______________________。
(3)控制城市污染源的方法可以有____________(多选扣分)。
a、开发氢能源 b、使用电动车
c、植树造林 d、戴上呼吸面具
24、(5分)某无色溶液可能含有下列钠盐中的几种:A、氯化钠;B、硫化钠;C、亚硫酸钠;D、硫代硫酸钠;E、硫酸钠;F、碳酸钠。向此溶液中加入适量稀H2SO4,有浅黄色沉淀析出,同时有气体产生,此气体有臭鸡蛋气味,可使澄清的石灰水变浑浊,不能使品红试液褪色。根据上述实验现象回答下列问题。
(1)不能使品红试液褪色,说明该气体不含_________(填分子式)。
(2)此无色溶液中至少存在哪几种钠盐?请写出全部可能的情况(填写相应的字母)。第一种情况____________,第二种情况____________,第三种情况______________,第四种情况__________(可不填满,也可补充)。
[答案] 六、计算题(本题包括2小题,共11分)
25、(5分)某工厂每天烧掉100t含硫0.96%的烟煤,为防止SO2污染环境,用生石灰吸收SO2,最终转化为石膏(CaSO4·2H2O)。试计算理论上每年(365天)可生成石膏多少吨?
[答案]
26、(6分)两分不同浓度的NaOH溶液各500mL,分别吸收1120mL(标准状况下体积)SO2气体,反应后溶液中分别有5.75g和7.10g溶质。求两份NaOH溶液的物质的量浓度。
[答案] - 返回 -
|


