1、氨分子结构
氨分子的电子式为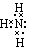 ;结构式为
;结构式为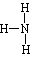 ;分子中含有3个N—H极性键,键角为107°18′,分子空间构型为三角锥形,氨分子是极性分子。
;分子中含有3个N—H极性键,键角为107°18′,分子空间构型为三角锥形,氨分子是极性分子。
2、氨的物理性质
氨气为无色、有刺激性气味的气体,比空气轻,很容易液化,极易溶于水,常温常压下,1体积水能溶解700体积氨气。
3、氨的化学性质
(1)氨与水的反应
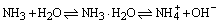
注:氨水
①NH3溶于水所得溶液叫氨水;
②氨水是混合物,溶液中有 NH3、H2O、NH3·H2O、NH4+、OH-及少量的H+;而液氨是氨气经加压或降温后形成的液态物质,液氨所含的微粒是NH3,故它是纯净物。
③氨水溶质为 NH3,氨水的密度比水小,且溶质的质量分数越大,密度越小。最浓的氨水的质量分数为35.28%,密度为0.88g/cm3。一般市售浓氨水的的密度为0.8980g/cm3,质量分数为28%,物质的量浓度为14.8mol/L。
④氨水显碱性,氨水盛装在玻璃容器、橡皮袋、陶瓷坛或内涂沥青的铁桶里;氨气是碱性气体,若不慎接触过多的氨时,要及时吸入新鲜空气和水蒸气,并用大量水冲洗眼睛。
⑤ NH3·H2O不能写成NH4OH。
⑥氨水不稳定,受热易分解,且易挥发,
NH3·H2O NH3↑+H2O
NH3↑+H2O
喷泉实验:
①操作要领:在干燥的圆底烧瓶里充满NH3,用带有玻璃管和滴管(滴管里预先吸入水)的塞子塞紧瓶口。立即倒置烧瓶,使玻璃管插入盛有水的烧杯里(水里事先加入少量的酚酞试液)。安装好装置,打开橡皮管上的夹子,挤压滴管的胶头,使少量水进入烧瓶。
②引发水上喷的操作是:打开止水夹,挤出胶头滴管的水。
③实验原理:氨气极易溶解于水,致使烧瓶内气体压强迅速减小。
④溶液显红色的原因:氨水显碱性。
(2)氨与酸反应
NH3+HCl=NH4Cl(白烟)
NH3+HNO3=NH4NO3(白烟)
2NH3+H2SO4=(NH4)2SO4(无现象)
反应的实质:NH3+H+=NH4+
总结:
挥发性的强酸与氨气在空气中相遇便产生白烟,如NH3遇HCl、HBr、HI、HNO3均有白烟产生,而遇H2SO4、H3PO4则无此现象。
(3)氨的还原性
氨的催化氧化:4NH3+5O2 4NO+6H2O
4NO+6H2O
在纯氧中燃烧:4NH3+3O2 2N2+6H2O
2N2+6H2O
与Cl2反应:2NH3+Cl2=N2+6HCl(NH3不足量)
8NH3+Cl2=N2+6NH4Cl(NH3足量)
与CuO反应:2NH3+3CuO N2+3Cu+3H2O
N2+3Cu+3H2O