|
一、一周知识概述
1、化学平衡的建立
(1)化学平衡研究的对象——可逆反应进行的程度。
(2)化学平衡状态
化学平衡状态是指在一定条件下的可逆反应里,正反应速率等于逆反应速率,反应混合物中各组分的浓度保持不变的状态。
(3)化学平衡的特征
①“动”,化学平衡是动态平衡,即处于化学平衡状态时,化学反应并没有停止,而是正逆反应速率相等罢了。
②“定”,由于达到化学平衡状态时的正逆反应速率相等,所以,该状态下反应混合物中各组分的质量分数保持一定,不再改变。
③“变”,化学平衡是有条件的,即“定”是相对的、暂时的,而“动”则是绝对的。当改变影响化学平衡的某一个条件(如温度、压强、浓度)时,原有的化学平衡状态会被破坏,直至在新的条件下建立新的平衡状态。
2、化学平衡常数
(1)化学平衡常数的数学表达式
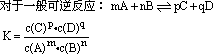
(2)化学平衡常数表示的意义
平衡常数数值的大小可以反映可逆反应进行的程度大小,K值越大,反应进行越完全,反应物转化率越高,反之则越低。
3、影响化学平衡的条件
(1)浓度:
增大反应物浓度或减小生成物浓度都会使平衡向正反应方向移动。
(2)温度:
升高温度平衡向吸热反应方向移动,降低温度平衡向放热反应方向移动。
(3)压强:
对于有气体参加的反应,增大压强平衡向气体体积减小的反应方向移动,减小压强平衡向气体体积增大的反应方向移动。
二、重点、难点知识解析
1、化学平衡状态的判断
本质:υ正=υ逆
现象:
(1)各组成成份的含量保持不变;
(2)各物质浓度不随时间改变而改变;
(3)各物质的物质的量不随时间改变而改变;
(4)对于有气体参加,且反应前后气体体积有改变的反应,混合气体的体积或压强或气体物质的量不随时间改变而改变。对于反应: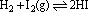 ,压强不随时间改变而改变不能作为判断化学平衡状态的标志。 ,压强不随时间改变而改变不能作为判断化学平衡状态的标志。
2、化学平衡是动态平衡
可逆反应在一定条件下建立平衡状态时,正反应、逆反应均未停止,只是正逆反应速
率相等而已。
3、化学反应速率的改变与化学平衡移动的关系
(1)化学平衡移动的概念
一定条件下的化学平衡(υ正=υ逆,各组分含量保持一定) 平衡破坏(υ正≠υ逆) 平衡破坏(υ正≠υ逆) 新的条件下建立新的平衡状态(υ正′=υ逆′)各组分含量保持新的一定。 新的条件下建立新的平衡状态(υ正′=υ逆′)各组分含量保持新的一定。
(2)影响化学平衡的条件
①浓度
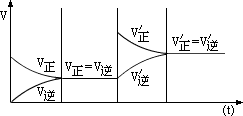
增大反应物浓度、正逆反应速率都加快,但υ正>υ逆,因此,平衡向正反应方向移动。如图所示。
②压强
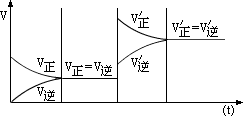
对于反应没有气体参加的可逆反应及反应前后气体体积不改变的反应,改变压强化学平衡不移动。对于反应前后气体体积有改变的反应,如: ,增大压强,反应物、生成物压强都相应增大,正逆反应速率都加快,但υ正>υ逆,平衡向正反应方向移动,如图所示。 ,增大压强,反应物、生成物压强都相应增大,正逆反应速率都加快,但υ正>υ逆,平衡向正反应方向移动,如图所示。
③温度
无论是吸热反应还是放热反应,升高温度反应速率都加快,达到化学平衡的时间就短,降低温度反应速率则减慢,达到化学平衡状态所需时间就长。
例如: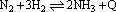 ,升高温度。如图所示。 ,升高温度。如图所示。
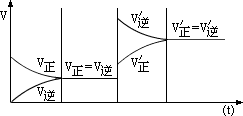
υ正′=υ逆′,平衡向吸热反应方向移动。
三、典型例题
例1、(全国卷)、右图是温度和压强对X+Y 2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( ) 2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
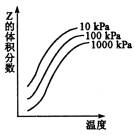
A.上述可逆反应的正反应为放热反应
B.X、Y、Z均为气态
C.X和Y中只有一种为气态,Z为气态
D.上述反应的逆反应的△H>0
答案:C
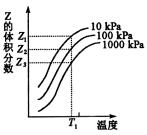
解析:
在可逆反应x+y 2z混和气体中z的体积分数愈大说明平衡向正反应方向移动。当温度一定时如图所示设为T1,当压强由10kPa依次增大至100 kPa 1000kPa时在平衡混和物中z的体积分数依次从z1减小至z2、z3这就表明当温度一定时增大压强平衡向逆反应方向移动,由此可知可逆反应:x+y 2z混和气体中z的体积分数愈大说明平衡向正反应方向移动。当温度一定时如图所示设为T1,当压强由10kPa依次增大至100 kPa 1000kPa时在平衡混和物中z的体积分数依次从z1减小至z2、z3这就表明当温度一定时增大压强平衡向逆反应方向移动,由此可知可逆反应:x+y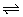 2z的逆反应是一个气体体积缩小的反应,据此可知x和y中只有一种为气态,z为气态,C选项正确。当压强一定时设为10kPa升高温度,z在平衡混和气体中体积分数增大,说明平衡向正反应方向移动。因此该反应的正反应是吸热反应,逆反应是放热反应,所以逆反应的△H<0,D错。 2z的逆反应是一个气体体积缩小的反应,据此可知x和y中只有一种为气态,z为气态,C选项正确。当压强一定时设为10kPa升高温度,z在平衡混和气体中体积分数增大,说明平衡向正反应方向移动。因此该反应的正反应是吸热反应,逆反应是放热反应,所以逆反应的△H<0,D错。
例2、应:L(固)+aG(气)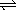 bR(气)达到平衡时,温度和压强对该反应的影响如图所示,图中:压强p1>p2,X轴表示温度,Y轴表示平衡混合气中G的体积分数。据此可判断( ) bR(气)达到平衡时,温度和压强对该反应的影响如图所示,图中:压强p1>p2,X轴表示温度,Y轴表示平衡混合气中G的体积分数。据此可判断( )
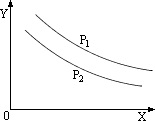
A.上述反应是放热反应 B.上述反应是吸热反应
C.a>b D.a<b
答案:BD
解析:
该曲线是递减的。当温度升高时,G气体在混合气体中在下降,表明平衡向正反应方向移动,所以该反应为吸热反应。又因为P1>P2,由P1→P2是减小压强,G的体积分数在减少,平衡向正反应方向移动,即减小压强,平衡向正反应方向移动,也就是平衡向体积扩大的方向移动,a<b。
点评:
解化学平衡移动与图象的题时,要看清横坐标和纵坐标代表的意义,把图像中描述的化学平衡与化学平衡移动的原理相对应。同时还要注意逆向思维,即已知可逆反应和平衡移动的条件,求图像的纵坐标表示的意义。
- 返回 -
|